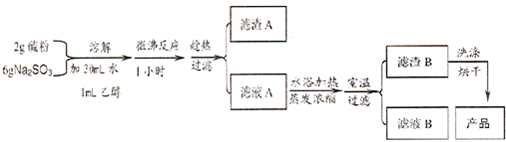
题目内容
实验室进行某项实验并检验反应产物的装置如图1所示.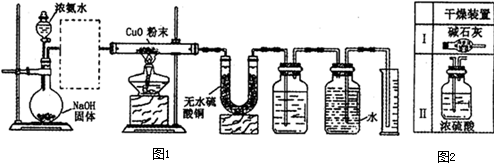
将足量浓氨水从分液漏斗中加入烧瓶中后,如图1进行实验,实验现象记录如下:
①黑色氧化铜粉末变为光亮红色;
②无水硫酸铜粉末变蓝色
③广口瓶收集到一种新生成的无色气体
(1)虚线框内是否应添加必要的干燥装置? (填“是”或“否”),若需要,应选择右图2中的干燥装置是 (填编号,若不需要,该空可不填).
(2)在实验中NaOH固体的作用是 .
(3)最终广口瓶中收集到的气体是 ,CuO粉末处发生化学反应方程式为 .
(4)洗气瓶中的试剂是 ,去掉此装置有何影响? .
(5)实验时充分加热,至硬质玻璃管装置质量不再减轻为止.实验完毕后,测得收集到的气体体积为a L(已折算为标注状况).则若用CH4还原同样多CuO,理论上最少需要CH4的体积为(标准状况,用含字母a的代数式表示) L.

将足量浓氨水从分液漏斗中加入烧瓶中后,如图1进行实验,实验现象记录如下:
①黑色氧化铜粉末变为光亮红色;
②无水硫酸铜粉末变蓝色
③广口瓶收集到一种新生成的无色气体
(1)虚线框内是否应添加必要的干燥装置?
(2)在实验中NaOH固体的作用是
(3)最终广口瓶中收集到的气体是
(4)洗气瓶中的试剂是
(5)实验时充分加热,至硬质玻璃管装置质量不再减轻为止.实验完毕后,测得收集到的气体体积为a L(已折算为标注状况).则若用CH4还原同样多CuO,理论上最少需要CH4的体积为(标准状况,用含字母a的代数式表示)
考点:性质实验方案的设计
专题:实验设计题
分析:实验检验反应产物,氨气与CuO反应生成Cu、N2、H2O,浓氨水与NaOH可制取氨气,混有水蒸气干扰反应产物检验,则制备的氨气应先用碱石灰干燥,再与CuO反应,然后无水硫酸铜变蓝检验水的生成,大试管中黑色氧化铜粉末变为光亮红色可说明Cu的生成,集气瓶中收集到一种无色气体即为氮气,以此来解答.
解答:
解:(1)制取氨气时混有水,干扰氨气与CuO反应产物的检验,则虚线框内是应添加必要的干燥装置,氨气与浓硫酸反应,应利用I中碱石灰干燥,
故答案为:是;I;
(2)浓氨水与NaOH可制取氨气,氢氧化钠固体吸水放出大量的热,会促使一水合氨分解产生氨气,故答案为:促使一水合氨分解产生氨气;
(3)根据实验记录的现象,可以知道氨气还原氧化铜可以得到金属铜、氮气以及水,但其可以根据排水量气法来测定体积,CuO粉末处发生化学反应方程式为2NH3+3CuO
3Cu+N2+3H2O,Cu为固体,只有氮气为气体,则最终集气瓶中收集到的气体是N2,
故答案为:N2;2NH3+3CuO
3Cu+N2+3H2O;
(4)在洗气瓶中要加入浓硫酸,否则会造成右边装置中的水蒸气使无水硫酸铜变蓝色,无法判断是否有水生成,
故答案为:浓硫酸;广口瓶中的水蒸气会进入U形管中,影响生成的水的鉴别;
(5)实验完毕后,测得收集到的氮气体积为a L(已折算为标注状况),根据反应:2NH3+3CuO
3Cu+N2+3H2O,氧化铜的物质的量是
mol,甲烷还原氧化铜的原理是:CH4+4CuO
CO2+2H2O+4Cu,则消耗甲烷的物质的量是
mol,标况下的体积是0.75a,故答案为:0.75a.
故答案为:是;I;
(2)浓氨水与NaOH可制取氨气,氢氧化钠固体吸水放出大量的热,会促使一水合氨分解产生氨气,故答案为:促使一水合氨分解产生氨气;
(3)根据实验记录的现象,可以知道氨气还原氧化铜可以得到金属铜、氮气以及水,但其可以根据排水量气法来测定体积,CuO粉末处发生化学反应方程式为2NH3+3CuO
| ||
故答案为:N2;2NH3+3CuO
| ||
(4)在洗气瓶中要加入浓硫酸,否则会造成右边装置中的水蒸气使无水硫酸铜变蓝色,无法判断是否有水生成,
故答案为:浓硫酸;广口瓶中的水蒸气会进入U形管中,影响生成的水的鉴别;
(5)实验完毕后,测得收集到的氮气体积为a L(已折算为标注状况),根据反应:2NH3+3CuO
| ||
| 3a |
| 22.4 |
| △ |
| 0.75a |
| 22.4 |
点评:本题考查性质实验方案的设计,为高频考点,把握物质的性质及产物检验时排除干扰为解答的关键,注意实验装置图的作用及发生的反应,侧重分析能力及实验能力的考查,题目难度不大.

练习册系列答案
相关题目
短周期元素X、Y、Z、R、W五种元素原子序数依次增大,其中X与Z、Y与W分别为同族元素.原子半径X<Y<W<R<Z,W原子的最外层电子数比内层电子总数少4,Z、R的核外电子数之和与Y、W核外电子数之种相等.下列说法不正确的是( )
| A、Y、Z、R的简单离子具有相同的电子层结构 |
| B、X、Z分别与Y均可形成A2B与A2B2型化合物,且A2B2均有较强的氧化性 |
| C、X2Y分子同存在氢键,故X2Y比X2W稳定 |
| D、由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生复分解反应 |
最近,兰州近代物理研究所研制出我国首批氧-18气体(18O2).氧-18是氧的一种同位素,称为重氧,下列说法正确的是( )
| A、1.8g氧-18气体的物质的量是0.1mol |
| B、0.1mol重氧气体的体积是2.24L |
| C、重氧气体的摩尔质量为36g |
| D、0.1mol重氧水所含中子数约是6.02×1023个 |
常温下单质硫主要以S8形式存在.加热时,S8会转化为S6、S4、S2等.当温度达到750℃时,硫蒸气主要以S2形式存在(占92%).下列说法中正确的是( )
| A、S8转化为S6、S4、S2属于物理变化 |
| B、不论哪种硫分子,完全燃烧时都生成SO2 |
| C、S8、S6、S4、S2均属于共价化合物 |
| D、把硫单质在空气中加热到750℃即得S2 |
下列对物质的分类正确的是( )
| A、盐酸 酸 |
| B、纯碱 碱 |
| C、二氧化硫 酸性氧化物 |
| D、生石灰 盐 |
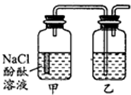 某课外活动小组,将剪下的一块镀锌铁放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是( )
某课外活动小组,将剪下的一块镀锌铁放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是( )| A、乙中导气管里形成一段水柱 |
| B、乙中导气管中产生气泡 |
| C、金属片剪口处溶液变红 |
| D、锌被腐蚀 |