题目内容
某校课外活动小组为了探究铜与稀硝酸反应产生的是NO气体,设计了如下实验.实验装置如图所示:

(1)装置A中生成CO2的作用是 ;打开K,当 时,关闭K.装置A中反应的离子方程式是 ;
(2)在(1)中的操作后将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是 ;B中反应的离子方程式是 .

(1)装置A中生成CO2的作用是
(2)在(1)中的操作后将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是
考点:性质实验方案的设计,硝酸的化学性质
专题:实验题
分析:由实验装置及流程可知,A中发生硝酸与碳酸钙的反应生成二氧化碳,因烧瓶中有空气,则生成的NO能与氧气反应生成二氧化氮,利用A装置反应生成的二氧化碳气体赶净装置中的空气避免对一氧化氮气体检验的干扰;B中发生Cu与硝酸的反应生成NO、硝酸铜,E中收集到无色气体NO,利用F冲入空气,可检验NO的生成;C装置可检验二氧化碳充满B、E装置;D装置为尾气处理装置,吸收氮的氧化物,防止污染空气,以此解答该题.
解答:
解:(1)因NO与氧气反应生成红棕色的二氧化氮气体,为排除对实验的影响,利用生成的CO2将整套装置内的空气赶尽,以排除对Cu与稀HNO3反应生成的气体产物观察的干扰,当装置C中产生白色沉淀时,可停止通入二氧化碳,A中发生反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,
故答案为:利用生成的CO2将整套装置内的空气赶尽,以排除对Cu与稀HNO3反应生成的气体产物观察的干扰;当装置C中产生白色沉淀;CaCO3+2H+═Ca2++CO2↑+H2O;
(2)因铜与稀硝酸反应生成硝酸铜、NO和水,其离子反应为3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,观察到气泡冒出和溶液变为蓝色,
故答案为:铜丝逐渐溶解并产生气泡,稀硝酸液面上气体仍为无色,溶液变为蓝色;3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
故答案为:利用生成的CO2将整套装置内的空气赶尽,以排除对Cu与稀HNO3反应生成的气体产物观察的干扰;当装置C中产生白色沉淀;CaCO3+2H+═Ca2++CO2↑+H2O;
(2)因铜与稀硝酸反应生成硝酸铜、NO和水,其离子反应为3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,观察到气泡冒出和溶液变为蓝色,
故答案为:铜丝逐渐溶解并产生气泡,稀硝酸液面上气体仍为无色,溶液变为蓝色;3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
点评:本题考查性质实验方案的设计,为高频考点,把握实验装置的作用、发生的反应及NO易被氧化为解答的关键,侧重分析能力与实验能力的综合考查,题目难度中等.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
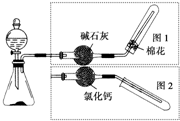 如图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示.下列选项中正确的是( )
如图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示.下列选项中正确的是( )| 发生装置中的药品 | 干燥和集气装置 | |
| A | 铜和稀硝酸 | 图2 |
| B | 氧化钙和浓氨水 | 图2 |
| C | 锌和稀盐酸 | 图1 |
| D | 大理石和稀盐酸 | 图1 |
| A、A | B、B | C、C | D、D |
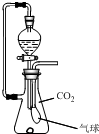 在抽滤瓶内放一小块金属钠,同时收集满CO2气体并塞紧瓶塞.从分液漏斗中放入一定量的水,待钠完全反应并恢复到反应前温度时,发现气球凹瘪,则抽滤瓶内溶液中的溶质是( )
在抽滤瓶内放一小块金属钠,同时收集满CO2气体并塞紧瓶塞.从分液漏斗中放入一定量的水,待钠完全反应并恢复到反应前温度时,发现气球凹瘪,则抽滤瓶内溶液中的溶质是( )| A、NaOH与Na2CO3 |
| B、Na2CO3 |
| C、Na2CO3与NaHCO3 |
| D、NaHCO3 |
污水处理厂检测出一批污水中含有较多的重金属Ag+,欲将其除去,应加入适量的( )
| A、NaCl |
| B、BaSO4 |
| C、Al2O3 |
| D、HNO3 |
我国著名化工专家侯德榜先生提出的“侯氏制碱法”大大推进了纯碱工业的发展,他的贡献之一是( )
| A、找到了新型高效催化剂 |
| B、充分利用了能量 |
| C、提高了纯碱产品的纯度 |
| D、有效减少了环境污染 |
下列根据实验现象所得出的结论中,错误的是( )
| A、向无色溶液加入盐酸酸化的氯化钡溶液有白色沉淀,结论:溶液中含有SO42- |
| B、无色溶液焰色反应呈黄色,结论:溶液中含有Na+ |
| C、向无色试液加入硝酸酸化的硝酸银溶液产生白色沉淀,结论:溶液中含Cl-- |
| D、向某溶液中加入氢氧化钠溶液加热,有能使湿润的红色石蕊试纸变蓝的气体生成,结论:溶液中含有NH4+ |
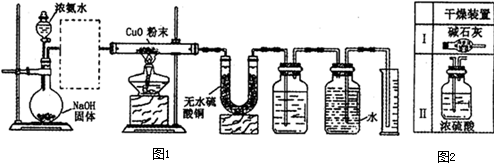
 根据要求完成下列各小题实验目的.(a、b 为弹簧夹,加热及固定装置已略去)
根据要求完成下列各小题实验目的.(a、b 为弹簧夹,加热及固定装置已略去)