题目内容
等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的
(同温同压),这时混合气体中N2、O2、CO2物质的量之比为( )
| 8 |
| 9 |
| A、3:4:1 |
| B、3:3:2 |
| C、6:7:3 |
| D、6:9:1 |
考点:有关混合物反应的计算
专题:
分析:氧气和氮气都不和过氧化钠反应,二氧化碳和过氧化钠反应生成氧气,根据反应前后体积的变化判断出二氧化碳有剩余,再根据反应的化学方程式计算混合气体中N2、O2、CO2物质的量之比.
解答:
解:设三者的物质的量分别为3mol,发生的反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,
现气体体积变为原来的
,即剩余气体的物质的量为8mol,
若二氧化碳完全与过氧化钠反应,则气体的物质的量减少1.5 mol,即剩余气体为7.5 mol,说明二氧化碳有剩余,
设有xmol二氧化碳参加反应,则有3+3+0.5x+(3-x)=8,解得:x=2,
所以反应后N2的物质的量为3mol,O2的物质的量为4mol,CO2的物质的量为1mol,
反应后的混合气体中N2、O2、CO2的物质的量之比为3:4:1,
故选A.
现气体体积变为原来的
| 8 |
| 9 |
若二氧化碳完全与过氧化钠反应,则气体的物质的量减少1.5 mol,即剩余气体为7.5 mol,说明二氧化碳有剩余,
设有xmol二氧化碳参加反应,则有3+3+0.5x+(3-x)=8,解得:x=2,
所以反应后N2的物质的量为3mol,O2的物质的量为4mol,CO2的物质的量为1mol,
反应后的混合气体中N2、O2、CO2的物质的量之比为3:4:1,
故选A.
点评:本题考查有关混合物的计算,题目难度不大,注意明确通过过氧化钠时,因为二氧化碳变为氧气,引起体积变化,注意差量法在化学计算中的应用方法,试题有利于培养学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
现有Fe(OH)3和FeS的混合物28.3g与足量的稀硫酸反应后,生成1.6g单质硫,则原混合物中所含Fe(OH)3的质量可以是下列的( )
| A、10.7g |
| B、21.4g |
| C、23.9g |
| D、40.0g |
 在某一容积可变的密闭容器中,可逆反应A(g)+B(g)?xC(g)△H,符合图象(Ⅰ)所示关系.由此推断,对图象(Ⅱ)的说法不正确的是( )
在某一容积可变的密闭容器中,可逆反应A(g)+B(g)?xC(g)△H,符合图象(Ⅰ)所示关系.由此推断,对图象(Ⅱ)的说法不正确的是( )| A、p3>p4,Y轴表示A的转化率 |
| B、p3>p4,Y轴表示B的质量分数 |
| C、p3>p4,Y轴表示混合气体的密度 |
| D、p3>p4,Y轴表示混合气体的平均相对分子质量 |
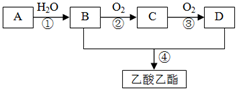 已知:A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.回答下列问题:
已知:A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.回答下列问题: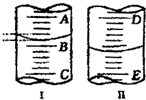 (1)图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为5,量筒中液体体积是
(1)图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为5,量筒中液体体积是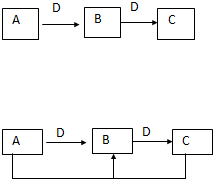 在一定条件下进行下列化学反应,请根据以下的转化关系回答下列问题(注:A、B、C中均含有同一种元素):
在一定条件下进行下列化学反应,请根据以下的转化关系回答下列问题(注:A、B、C中均含有同一种元素):