题目内容
7.NA表示阿伏加德罗常数的值,下列说法中正确的是( )| A. | 0.1mol的NaHSO4溶液中含0.2NA个阳离子 | |
| B. | 1L0.1mol/L的乙醇溶液中所含的分子总数为0.1NA个 | |
| C. | 在标准状况下,含NA个氦原子(He)的氦气所含的分子数是0.5NA个 | |
| D. | 1mol FeCl3跟沸水完全反应转化为氢氧化铁胶体,其中胶粒的数目一定少于NA个 |
分析 A.该溶液中还含有水电离的氢离子,则含有阳离子的物质的量大于0.2mol;
B.乙酸溶液中除了含有乙酸分子,还含有水分子;
C.稀有气体为单原子分子,含NA个氦原子(He)的氦气的物质的量为1mol;
D.氢氧化铁胶粒为氢氧化铁的聚集体.
解答 解:A.0.1molNaHSO4中含有0.2mol阳离子,由于水能够电离出氢离子,则溶液中含有的阳离子大于0.2mol,含有阳离子数目大于0.2NA个,故A错误;
B.1L0.1mol/L的乙醇溶液中还含有水分子,则该一中含有分子总数大于0.1NA,故B错误;
C.含NA个氦原子(He)的氦气的物质的量为1mol,所含的分子数是NA个,故C错误;
D.1mol FeCl3跟沸水完全反应转化为氢氧化铁胶体,由于氢氧化铁胶粒为氢氧化铁的聚集体,则含有胶粒的数目一定少于NA个,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,C为易错点,注意明确稀有气体为单原子分子,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
1.有关下列图象的分析错误的是( )
| A. |  图可表示对平衡N2(g)+3H2(g)?2NH3(g)加压、同时移除部分NH3时的速率变化 | |
| B. |  图中a、b曲线只可表示反应H2(g)十I2(g)?2HI(g)在有催化剂和无催化剂存在下建立平衡的过程 | |
| C. | 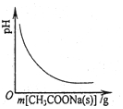 图表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化 | |
| D. | 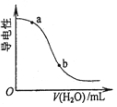 图表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH:a<b |
2.体积为VmL,密度为ρg•mL-1的含有相对分子质量为M的某种物质(不含结晶水)的溶液,其中溶质为mg,其物质的量浓度为C mol/L,溶质的质量分数为W%,则下列表示正确的是( )
| A. | c=1000Wρ/M | B. | m=VρW/100 | C. | W%=cM/1000ρ% | D. | c=100m/VM |
12.下列说法正确的是( )
| A. | 乙烷和乙醇是同系物 | |
| B. | 有机化合物一定含有碳元素 | |
| C. | 苯和甲苯都属于饱和烃 | |
| D. | 含有碳元素的化合物一定是有机化合物 |
19.用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 标准状况下,6.72LO2和N2的混合气体含有的原子数为0.6NA | |
| B. | 通常状况下,8g O2和O3的混合气体含有的分子数是0.5NA | |
| C. | 常温常压下,2mol/L的100mL MgCl2溶液中,含有Cl- 个数为0.4NA | |
| D. | 标准状况下,11.2L He分子数为0.5NA |
16. 一定温度下,在冰醋酸加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.下列说法正确的是( )
一定温度下,在冰醋酸加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.下列说法正确的是( )
 一定温度下,在冰醋酸加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.下列说法正确的是( )
一定温度下,在冰醋酸加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.下列说法正确的是( )| A. | a、c两点pH不同 | |
| B. | 向c溶液中加水,溶液中所有离子浓度都减小 | |
| C. | 误用湿润的pH试纸测b点pH结果偏大 | |
| D. | $\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$b点大于c点 |
