题目内容
16. 一定温度下,在冰醋酸加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.下列说法正确的是( )
一定温度下,在冰醋酸加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.下列说法正确的是( )| A. | a、c两点pH不同 | |
| B. | 向c溶液中加水,溶液中所有离子浓度都减小 | |
| C. | 误用湿润的pH试纸测b点pH结果偏大 | |
| D. | $\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$b点大于c点 |
分析 A、由图可知a、c两点导电能力相同,所以氢离子的浓度相同;
B、向c溶液中加水,溶液中氢离子的浓度减小,但氢离子与氢氧根离子的积是个定值;
C、湿润的pH试纸,相当于给原溶液稀释;
D、$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$相当于醋酸根离子和醋酸的物质的量之比,加水稀释,醋酸的物质的量减小,而醋酸根离子的物质的量增强,所以b点小于c点;
解答 解:A、由图可知a、c两点导电能力相同,所以氢离子的浓度相同,而不是不同,故A错误;
B、向c溶液中加水,溶液中氢离子的浓度减小,但氢离子与氢氧根离子的积是个定值,所以氢氧根离子的浓度增加,故B错误;
C、湿润的pH试纸,相当于给原溶液稀释,所以测b点pH结果偏大,故C正确;
D、$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$相当于醋酸根离子和醋酸的物质的量之比,加水稀释,醋酸的物质的量减小,而醋酸根离子的物质的量增强,所以b点小于c点,故D错误;
故选C.
点评 本题考查电解质的电离,题目难度中等,加水稀释醋酸,能促进醋酸电离,D选项中求两者的浓度之比,实际就是求物质的量之比,为易错点.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
7.NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 0.1mol的NaHSO4溶液中含0.2NA个阳离子 | |
| B. | 1L0.1mol/L的乙醇溶液中所含的分子总数为0.1NA个 | |
| C. | 在标准状况下,含NA个氦原子(He)的氦气所含的分子数是0.5NA个 | |
| D. | 1mol FeCl3跟沸水完全反应转化为氢氧化铁胶体,其中胶粒的数目一定少于NA个 |
4.4.6克的钠均分为二份,一份直接加入水中后配成1L溶液,另一份放在空气中加热燃烧生成过氧化钠后再溶于水中配成1L溶液,所得溶液浓度分别为a mol•L-1和bmol•L-1,则a与b的关系为( )
| A. | a=b | B. | a=2b | C. | 2a=b | D. | 以上都不对 |
11.针对平衡2SO2(g)+O2(g)?2SO3(g),采用下列措施一段时间后,能增大逆反应速率的是( )
| A. | 通入大量O2 | B. | 增大容器容积 | C. | 移去部分SO3 | D. | 降低体系温度 |
1.下列关于平衡体系的各说法中不正确的是( )
| A. | 在N2+3H2?2NH3的平衡体系中,缩小体积,平衡向右移动,氨的产率增加 | |
| B. | 在CH3COOH?CH3COO-+H+的平衡体系中加入CH3COONa固体,平衡向左移动 | |
| C. | 对Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),升高温度,其Ksp一定增大 | |
| D. | 在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡向溶解的方向移动 |
5.下列四种溶液的pH 最小的是( )
| A. | 0.02mol/L醋酸溶液与0.02mol/LKOH溶液等体积混合液 | |
| B. | 0.01mol/L醋酸溶液 | |
| C. | 0.03mol/L醋酸溶液与0.01mol/LKOH浓液等体积混合液 | |
| D. | pH=2的硝酸溶液与pH=12KOH溶液等体积混合液 |
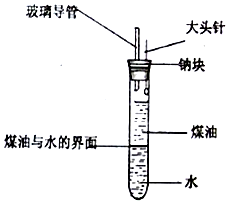 某化学研究性学习小组设计了如图所示的实验装置,目的是做钠与水反应的实脸并验证①钠的物理性质;②钠和水反应的产物.请回答下列问题:
某化学研究性学习小组设计了如图所示的实验装置,目的是做钠与水反应的实脸并验证①钠的物理性质;②钠和水反应的产物.请回答下列问题: