题目内容
9.室温时,有pH=12的Ba(OH)2溶液200mL,若把它的pH降到11,应加入0.017mol/L盐酸100mL.分析 由于混合后溶液显碱性,应先计算混合溶液中氢氧根离子浓度,再根据c(OH-)=$\frac{n(碱)-n(酸)}{V混}$来计算;
解答 解:设加入的盐酸的体积为VL,由于混合后溶液的pH=11,显碱性,故有:c(OH-)=10-3mol/L=$\frac{0.01mol/L×0.2L-0.017mol/L×VL}{0.2L+VL}$,解得V=0.1L,即100mL,故答案为:100.
点评 本题考查溶液pH的简单计算,利用假设法进行分析解答即可,难度不大.应注意的是混合后显什么性,要根据什么离子来计算.

练习册系列答案
相关题目
19.工业上利用Ga与NH3合成氮化镓的反应方程式为:2Ga(s)+2NH3(g)?2GaN(s)+3H2(g)△H<0
在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是( )

在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是( )

| A. | ①图象中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压 | |
| B. | ②图象中纵坐标可以为镓的转化率 | |
| C. | ③图象中纵坐标可以为化学反应速率 | |
| D. | ④图象中纵坐标可以为体系内混合气体平均相对分子质量 |
20.25℃时几种难溶电解质的溶解度如表所示:
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子.例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为Fe(OH)3(填化学式)而除去.
(2)①中加入的试剂应该选择氨水.
(3)②中除去Fe3+所发生的离子方程式为2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3.
(4)下列与方案③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
| 沉淀完全时的pH | 11.1 | 6.7 | 9.6 | 3.7 |
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为Fe(OH)3(填化学式)而除去.
(2)①中加入的试剂应该选择氨水.
(3)②中除去Fe3+所发生的离子方程式为2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3.
(4)下列与方案③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
17.物质的量相同的两份铝,分别放入足量的硫酸和氢氧化钠溶液中,放出的氢气在同温同压下的体积比为( )
| A. | 3:2 | B. | 1:6 | C. | 2:3 | D. | 1:1 |
1.下列有关蛋白质的叙述中,不正确的是( )
| A. | 重金属盐能使蛋白质变性,所以误食重金属盐会中毒 | |
| B. | 蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质析出,再加水也不溶解 | |
| C. | 浓HNO3溅在皮肤上,使皮肤呈黄色,是由于浓HNO3和蛋白质发生颜色反应 | |
| D. | 人工合成的具有生命活性的蛋白质-结晶牛胰岛素,是1965年我国科学家最先合成的 |
 已知水的电离平衡曲线如图所示,试回答下列问题:
已知水的电离平衡曲线如图所示,试回答下列问题: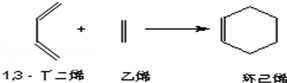
 ;B
;B
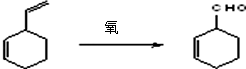
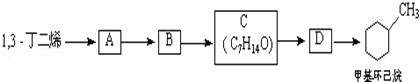
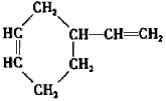
 下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )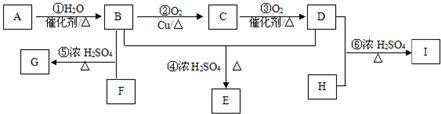
 .
.