题目内容
3.25℃,101k Pa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3kJ/mol;辛烷的燃烧热为5518kJ/mol.下列热化学方程式书写正确的是( )| A. | CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol | |
| B. | KOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=-57.3kJ/mol | |
| C. | C8H18(l)+$\frac{25}{2}$ O2 (g)═8CO2 (g)+9H2O(g)△H=-5518 kJ/mol | |
| D. | 2C8H18(g)+25O2 (g)═16CO2 (g)+18H2O(1)△H=-5518 kJ/mol |
分析 A.醋酸是弱酸,其电离过程吸热,则1mol反应放出的热量小于57.3 kJ;
B.氢氧化钾和硫酸为强电解质,结合中和热的概念分析;
C.辛烷的燃烧热为5518 kJ/mol,生成的水是H2O(1),不是H2O(g);
D.燃烧热是指1mol物质充分燃烧放出的热量.
解答 解:A.CH3COOH是弱酸,醋酸在电离过程中吸收热量,则1mol反应放出的热量小于57.3 kJ,故A错误;
B.KOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=-57.3kJ/mol,符合中和热的定义,故B正确;
C.辛烷的燃烧热为5518 kJ/mol,要求生成的水是H2O(1),不是H2O(g),故C错误;
D.燃烧热是指1mol物质充分燃烧放出的热量,则辛烷燃烧的热化学方程式为:C8H18(l)+$\frac{25}{2}$ O2(g)═8CO2(g)+18H2O(1)△H=-5518 kJ/mol,故D错误;
故选B.
点评 本题考查反应热、中和热、燃烧热的知识,题目难度中等,明确热化学方程式的书写原则为解答关键,注意掌握燃烧热、中和热的概念及应用,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
5.现有常温下pH=a的NaOH溶液与pH=b的硫酸溶液,将二者等体积混合,所得溶液为中性,则下列对两溶液的相关分析不正确是( )
| A. | KW均为1×10-14 | B. | 若a=12则b=2 | ||
| C. | a、b为固定值 | D. | 水电离出的c(H+)相等 |
11.短周期元素A、B、C、D的原子序数依次增大且互不同主族,A元素在自然界中存在两种气态单质,其中一种能吸收短波紫外线,A、B两元素的族序数之差为3,C、D不相邻,C的最外层电子数是次外层电子数的一半,下列判断正确的是( )
| A. | 简单离子的半径大小:D>B>A | |
| B. | B的单质既能和酸反应,又能和碱反应 | |
| C. | A分别与C、D形成的化合物均易溶于水 | |
| D. | 最高价氧化物对应水化物的酸性:C>D |
18.下列元素在自然界中仅以化合态存在的是( )
①Si ②Al ③Cl ④Fe ⑤Na.
①Si ②Al ③Cl ④Fe ⑤Na.
| A. | ①②⑤ | B. | ①② | C. | ①②③ | D. | ①②③⑤ |
8.下列用水就能鉴别的一组物质是( )
| A. | 苯、乙醇、四氯化碳 | B. | 苯、己烷、四氯化碳 | ||
| C. | 硝基苯、乙醇、四氯化碳 | D. | 硝基苯、乙醇、乙酸 |
12.已知溶质质量分数为96%的酒精溶液的物质的量浓度为16.6•mol•L-1,则8.3mol•L-1的酒精溶液的溶质的质量分数为( )
| A. | 大于48% | B. | 等于48% | C. | 小于48% | D. | 无法确定 |
13.下列说法不正确的是( )
| A. | 用加热法可除去Na2CO3中的NaHCO3 | |
| B. | 硝酸酸化的硝酸银溶液检验Cl- | |
| C. | 可用石灰水区分Na2CO3与NaHCO3溶液 | |
| D. | 热纯碱溶液可除去油污 |

 ,Y的名称是浓硫酸.
,Y的名称是浓硫酸.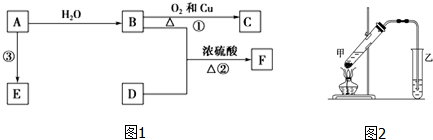
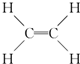 ,B中决定其性质的重要官能团的名称为羟基.
,B中决定其性质的重要官能团的名称为羟基.