题目内容
17.A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如表所示.| 元素 | 原子结构或性质 |
| A | 原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
| E | 与D同主族 |
| F | 与E同周期,且最外层电子数等于电子层数 |
(1)A在元素周期表中的位置是第三周期第ⅡA族;A与E形成的化合物的电子式是
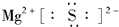 .
.(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是2Fe3++Cu═2Fe2++Cu2+.
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(4)F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
分析 由A的原子最外层电子数是内层电子总数的$\frac{1}{5}$,可知最外层电子数为2,内层电子总数为10,即A为Mg;B形成化合物种类最多的元素,其单质为固体,则B为C元素;C为生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5,可知两种氯化物分别为氯化铁、氯化亚铁,则C为Fe;D为地壳中含量最多的元素,D为O元素;E与D同主族,且为短周期元素,则E为S元素;F与E同周期,且最外层电子数等于电子层数,则F为第三周期第ⅢA的Al元素,然后结合元素周期律及元素化合物知识来解答.
解答 解:由A的原子最外层电子数是内层电子总数的$\frac{1}{5}$,可知最外层电子数为2,内层电子总数为10,即A为Mg;B形成化合物种类最多的元素,其单质为固体,则B为C元素;C为生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5,可知两种氯化物分别为氯化铁、氯化亚铁,则C为Fe;D为地壳中含量最多的元素,D为O元素;E与D同主族,且为短周期元素,则E为S元素;F与E同周期,且最外层电子数等于电子层数,则F为第三周期第ⅢA的Al元素,
(1)A为Mg,原子序数为12,在元素周期表中位于第三周期第ⅡA族;A与E分别为Mg、S,二者形成的化合物为硫化镁,硫化镁为离子化合物,其电子式是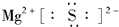 ,
,
故答案为:第三周期第ⅡA族;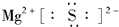 ;
;
(2)C为Fe,C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,该氯化物为氯化铁,反应的离子方程式是:2Fe3++Cu═2Fe2++Cu2+,
故答案为:2Fe3++Cu═2Fe2++Cu2+;
(3)B、D分别为C、O,C的单质与水在一定条件下反应生成CO和氢气,反应的化学方程式是:C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2,
故答案为:C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2;
(4)F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
点评 本题考查位置、结构与性质的关系,为高频考点,题目难度中等,把握元素的位置、元素的性质及元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意利用原子结构及元素化合物知识推断元素.

 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案| A. | 实验室制硝基苯时,将硝酸与苯混合后再滴加浓硫酸 | |
| B. | 在苯中加入酸性KMnO4溶液,振荡并静置后下层液体为紫色 | |
| C. | 苯酚钠溶液中通入少量二氧化碳生成苯酚和碳酸钠 | |
| D. | 实验时手指不小心沾上苯酚,立即用70℃以上的热水清洗 |
| A. | 氘(D)原子核外有1个电子 | |
| B. | H与D互称同位素 | |
| C. | H2O与D2O互称同素异形体 | |
| D. | 1H218O与D216O的相对分子质量相同 |
| 元素编号 | 元素性质或原子结构 |
| T | M层的电子数为K层电子数的3倍 |
| X | 其化合物的种类最多且其氢化物是一种清洁能源 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价+7价 |
 .
.(2)元素Y在周期表中的位置是第二周期ⅤA族.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示).下列表述中能证明这一事实的是bce.
a.常温下Z的单质和T的单质状态不同 b.Z的氢化物比T的氢化物稳定
c.Z的最高价氧物所对应的水化物比T的最高价氧化物所对应的水化物的酸性强
d.Z的氢化物笔比T的氢化物溶解度大
e.Z的单质与H2化合比T的单质与H2化合更容易
(4)结合所学的知识,请设计一个与(3)中的事实不同的实验方案证明元素Z与元素T的非金属性的强弱将氯气通入到Na2S溶液中,若产生淡黄色沉淀,则证明非金属性Cl>S.

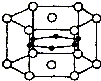 图为硼和镁两种元素组成的超导材料的晶体结构单元示意图,其中该化合物镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内.则该化合物的化学式可表示为MgB2.
图为硼和镁两种元素组成的超导材料的晶体结构单元示意图,其中该化合物镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内.则该化合物的化学式可表示为MgB2. 和
和  ;⑧丙烷和环丙烷.用序号填空:
;⑧丙烷和环丙烷.用序号填空: