题目内容
5.同温同压下,相同质量的下列各烃完全燃烧所需O2的量最多的是( )| A. | 甲烷 | B. | 乙烯 | C. | 乙炔 | D. | 丁二烯 |
分析 相同质量的各烃完全燃烧,耗氧量取决于H元素的质量分数,分子中H元素的质量分数越高,耗氧量越大,计算分子中C原子与H原子数目之比,相同C原子,H原子数目越大,H元素质量分数越大,据此解答.
解答 解:由C~O2~CO2,4H~O2~2H2O进行比较,消耗1molO2,需要12gC,而消耗1molO2,需要4gH,可知有机物含氢量越大,等质量时消耗的O2越多,
四个选项中CH4的含氢量最大,等质量时消耗的氧气应最多.
故选A.
点评 本题考查有机物耗氧量的判断,题目难度不大,本题可比较C、H原子消耗氧气的关系,利用关系式计算较为简单.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
15. 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格).
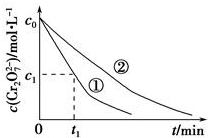
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示.
(2)上述反应中参加反应的Cr2O72-与草酸的物质的量之比为1:3.
(3)实验①和②的结果表明溶液pH对该反应的速率有影响;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三.
假设一:Fe2+起催化作用:
假设二:Al3+起催化作用;
假设三:SO42-起催化作用;…
(5)请你设计实验验证上述假设一,完成下表中内容.
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格).
| 验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | 20 |
(2)上述反应中参加反应的Cr2O72-与草酸的物质的量之比为1:3.
(3)实验①和②的结果表明溶液pH对该反应的速率有影响;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三.
假设一:Fe2+起催化作用:
假设二:Al3+起催化作用;
假设三:SO42-起催化作用;…
(5)请你设计实验验证上述假设一,完成下表中内容.
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
16.X、Y、Z、W为四种短周期元素,它们在周期表中位于连续的四个主族,如图所示.Z元素原子最外层电子数是内层电子总数的$\frac{1}{5}$.下列说法中正确的是( )
| X | Y | ||
| Z | W |
| A. | 原子半径由小到大的顺序为:X<Z<Y<W | |
| B. | Y元素最高价氧化物对应的水化物化学式为H3YO4 | |
| C. | X、Z两种元素的氧化物中所含化学键类型相同 | |
| D. | Y最简单气态氢化物比Y相邻周期同主族元素气态氢化物沸点高 |
20.针对下表中十种元素,填写空格.
(1)最不活泼的元素是Ar.
(2)S原子结构示意图 .
.
(3)N、F、Cl中原子半径最大的是Cl.
(4)最高价氧化物对应水化物酸性最强的是高氯酸(填名称).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅦA | ⅧA | O |
| 2 | N | O | F | |||||
| 3 | Na | Mg | Al | S | Cl | Ar | ||
| 4 | K | Ca |
(2)S原子结构示意图
 .
.(3)N、F、Cl中原子半径最大的是Cl.
(4)最高价氧化物对应水化物酸性最强的是高氯酸(填名称).
10.有机反应从不同角度可能属于不同反应类型,下列有关有机反应类型的描述正确的是( )
| A. | 乙醇可以通过消去反应生成乙醛 | |
| B. | 乙醛可以通过加成反应生成乙酸 | |
| C. | 苯酚可以通过苯发生水解反应制取 | |
| D. | 可以通过缩聚反应制取聚对苯二甲酸乙二酯 |
17.下列有关物质的分离与提纯正确的是( )
| A. | 取海带样品,灼烧得灰分,再溶解、过滤得到滤液后加CCl4萃取其中的碘 | |
| B. | 做Fe3+和Cu2+的纸层析实验时,用玻璃棒在标记好的原点处轻轻点样3~5次留下斑点 | |
| C. | 抽滤时,当吸滤瓶内液面高度快达到支管口时,应从支管口倒出溶液 | |
| D. | 除去氯化钠中混有的少量硝酸钾,先将混合物溶于水配成热的饱和溶液,然后蒸发水,当有大量晶体析出时,趁热过滤,硝酸钾留在滤液中 |
14.16O与18O互为同位素,下列说法正确的是( )
| A. | 16O与18O具有相同的物理性质 | B. | 16O与18O具有不同的电子数 | ||
| C. | 16O与18O具有相同的质子数 | D. | 16O2与18O3互为同位素 |
15.关于钠的叙述中,正确的是( )
| A. | 钠是银白色金属,硬度很大 | B. | 钠的密度比水小 | ||
| C. | 金属钠在空气中燃烧,生成氧化钠 | D. | 金属钠的熔点很高 |