题目内容
已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI+13I2+12K2SO4+12H2O下列说法正确的是( )
| A、CuI是氧化剂 |
| B、2mol氧化剂在反应中得到的电子为10 mol |
| C、24mol KI在反应中失去的电子为22mol |
| D、氧化剂与还原剂的物质的量之比为1:12 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:2Cu(IO3)2+24KI+12H2SO4=2CuI+13I2+12K2SO4+12H2O中,Cu元素的化合价由+2价降低为+1价,I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,该反应中转移22e-,以此来解答.
解答:
解:A.CuI为生成物,Cu元素得到电子后的生成物,为还原产物,故A错误;
B.Cu、I元素的化合价降低,Cu(IO3)2为氧化剂,2mol氧化剂在反应中得到的电子为22 mol,故B错误;
C.24mol KI在反应中只有22molKI作还原剂,失去的电子为22mol×[0-(-1)]=22mol,故C正确;
D.由反应可知,氧化剂与还原剂的物质的量之比为2:22=1:11,故D错误;
故选C
B.Cu、I元素的化合价降低,Cu(IO3)2为氧化剂,2mol氧化剂在反应中得到的电子为22 mol,故B错误;
C.24mol KI在反应中只有22molKI作还原剂,失去的电子为22mol×[0-(-1)]=22mol,故C正确;
D.由反应可知,氧化剂与还原剂的物质的量之比为2:22=1:11,故D错误;
故选C
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意从化合价角度分析,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是( )
| A、将饱和FeCl3溶液滴入沸水中形成胶体发生的是物理变化 |
| B、周期表中所有元素都是从自然界中发现的 |
| C、只有在原子中,质子数才与核外电子数相等 |
| D、化学反应过程中必然伴随着能量的变化 |
用NA代表阿伏加德罗常数,下列说法正确的是( )
| A、9g D2O中含有的电子数目为5NA |
| B、1mol Na2O2中所含的阴离子数约为2×6.02×1023 |
| C、1mol CH4所含共价键总数为4NA |
| D、7.1g Cl2与足量NaOH溶液反应转移的电子数为0.2NA |
海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法不正确的是( )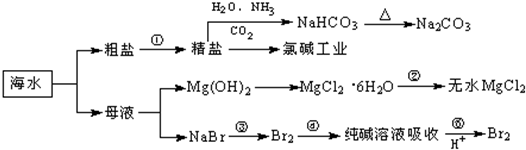

| A、由精盐制备NaHCO3的反应本质上属于复分解反应 |
| B、用澄清的石灰水可鉴别NaHCO3和Na2CO3 |
| C、氯碱工业是通过电解饱和食盐水得到烧碱、氯气和氢气;工业上制取金属镁是通过电解饱和MgCl2溶液 |
| D、在第④步反应中Br2既是氧化剂又是还原剂,在第⑤步反应中Br2既是氧化产物又是还原产物 |
只具有还原性的离子是( )
| A、MnO4- |
| B、NO3- |
| C、Br- |
| D、Fe2+ |
20g密度为pg?cm-3的硝酸钙液中含有1gCa2+离子,则该溶液中NO
的物质的量浓度为( )
- 3 |
A、
| ||
B、
| ||
| C、2.5pmol?L-1 | ||
| D、1.25mol?L-1 |
下表为四种溶液的溶质质量分数和物质的量浓度的数值
根据表中数据判断上述四种溶液中的密度最小的是( )
| 溶液 | KOH | HNO3 | CH3COOH | HCl |
| 溶质质量分数ω(%) | 56 | 63 | 60 | 36.5 |
| 物质的量浓度c(mol/L) | 14.3 | 13.8 | 10.6 | 11.8 |
| A、HCl |
| B、HNO3 |
| C、CH3COOH |
| D、KOH |
下列热化学方程式或离子方程式中,正确的是( )
| A、甲烷的标准燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1催化剂450℃、1MPa |
| B、450℃、1MPa下,将1mol SO2和0.5molO2置于密闭的容器中充分反应生成SO3(g),放热98.5kJ,其热化学方程式为:2SO2+O2(g)?2 SO3(g)△H=-98.5kJ?mol-1 |
| C、氯化镁溶液与氨水反应:Mg2++2OH-=Mg(OH)2↓ |
| D、用FeCl3溶液腐蚀铜箔:Cu+2Fe3+═2Fe2++Cu2+ |