题目内容
20.美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是( )| A. | 铝钠合金的熔点降低 | |
| B. | 铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na) | |
| C. | m g不同组成的铝钠合金投入足量盐酸中,若放出H2越多,则铝的质量分数越小 | |
| D. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 |
分析 A.依据合金熔点规律低于成分金属熔点解答;
B.依据钠与水反应生成氢氧化钠溶液,氢氧化钠溶液与铝反应生成可溶性偏铝酸钠溶液解答;
C.根据金属钠和金属铝和酸反应生成氢气量的关系:2Al~3H2↑,2Na~H2↑解答;
D.铝钠合金投入到足量氯化铜溶液中,钠和水反应生成的氢氧化钠可以和氯化铜反应生成氢氧化铜沉淀,若Al过量,则可生成铜.
解答 解:A.合金熔点规律低于成分金属熔点,所以铝钠合金的熔点降低,故A正确;
B.铝钠合金若投入一定的水中可得无色溶液,说明钠和水反应生成的氢氧化钠足以将金属铝溶解,则n(Al)≤n(Na),故B正确;
C.根据金属钠和金属铝和酸反应生成氢气量的关系:2Al~3H2↑,2Na~H2↑,等质量的金属钠和金属铝,则金属Al产生的氢气量多,所以放出的H2越多,则铝的质量分数越大,故C错误;
D.铝钠合金投入到足量氯化铜溶液中,钠和水反应生成的氢氧化钠可以和氯化铜反应生成氢氧化铜沉淀,若n(Al)>n(Na),金属铝也可能会置换出金属铜,故D正确;
故选:C.
点评 本题综合考查钠、铝的性质,题目难度中等,明确合金的性质及铝、钠的性质是解题关键,注意过程中发生的反应.

练习册系列答案
相关题目
8.下列物质用途不正确的是( )
| A. | 漂白液可作游泳池和环境的消毒剂 | |
| B. | SO2可用于杀菌,消毒,并使食品增白 | |
| C. | 硫酸可用于制化肥 | |
| D. | 氨可作制冷剂 |
10.下列各组离子中,在溶液里能大量共存,且溶液为无色透明的是( )
| A. | NH4+、NO3-、Al3+、Cl- | B. | Na+、SiO32-、NO3-、Fe3+ | ||
| C. | Na+、MnO4-、K+、SO42- | D. | Na+、HCO3-、SO42-、Al3+ |
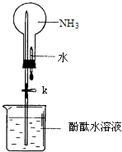 某学习小组欲制取氨气并探究其性质.请回答:
某学习小组欲制取氨气并探究其性质.请回答: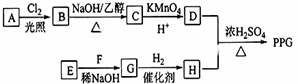

 .
. .
.
 (写结构简式)D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是有有c(填标号).
(写结构简式)D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是有有c(填标号).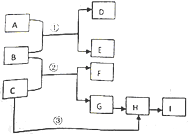 下列框图中物质均为中学化学常见物质.已知A、B、C均为有刺激性气味气体,A、B分别通入品红溶液中,红色均褪去;B、C分别通入紫色石蕊试液中,B使溶液先变红后褪色,C使溶液显蓝色;H为无色气体,I为红棕色气体,反应②有大量白烟生成.
下列框图中物质均为中学化学常见物质.已知A、B、C均为有刺激性气味气体,A、B分别通入品红溶液中,红色均褪去;B、C分别通入紫色石蕊试液中,B使溶液先变红后褪色,C使溶液显蓝色;H为无色气体,I为红棕色气体,反应②有大量白烟生成.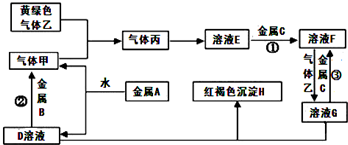 有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属.三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出).
有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属.三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出).