题目内容
10.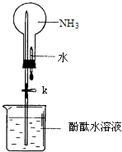 某学习小组欲制取氨气并探究其性质.请回答:
某学习小组欲制取氨气并探究其性质.请回答:(1)实验室利用固体与固体反应制取氨气的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)①上图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是轻轻挤压滴管,使少量水加入烧瓶,然后打开止水夹K.
②氨气使烧杯中溶液由无色变为红色,其原因是(用方程式表示)NH3+H2O?NH3•H2O?NH4++OH-.
(3)在上图的烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是C
A.HCl和H2O B.NH3和H2O C.NH3和苯 D.CO2和烧碱溶液.
分析 (1)氯化铵与氢氧化钙加热生成氯化钙、氨气和水;
(2)①氨气是极易溶于水的气体,使烧瓶内产生压强差导致溶液进入烧瓶;
②氨气与水反应生成一水合氨,一水合氨部分电离产生氢氧根离子和氨根离子,溶液显碱性;
(3)在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体,若挤压胶头滴管,形成喷泉,则气体极易溶于水、或气体极易与溶液反应,以此来解答.
解答 解:(1)氯化铵与氢氧化钙加热生成氯化钙、氨气和水,化学方程式:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)①NH3极易溶解于水,打开止水夹挤出胶头滴管中的水,然后打开止水夹K,由于氨气迅速溶解导致烧瓶内气体压强迅速减小,导致溶液进入烧瓶产生喷泉现象,
故答案为:轻轻挤压滴管,使少量水加入烧瓶,然后打开止水夹K;
②氨气与水反应生成一水合氨,一水合氨部分电离产生氢氧根离子和氨根离子,溶液显碱性,化学方程式:NH3+H2O?NH3•H2O?NH4++OH-
故答案为:NH3+H2O?NH3•H2O?NH4++OH-;
(3)A.氯化氢易溶于水,挤压胶头滴管,气体溶于水,体积减少,外压大于内压,形成喷泉,故A不选;
B.氨气极易溶于水,则挤压胶头滴管,气体减少,外压大于内压,形成喷泉,故B不选;
C.NH3和苯不反应,也不溶于水,不能形成压强差,不能形成喷泉,故C选;
D.挤压胶头滴管,CO2和NaOH溶液,气体减少,外压大于内压,形成喷泉,故D不选;
故选:C.
点评 本题考查了氨气的制备和喷泉实验,明确氨气制备原理及氨气的性质,熟悉喷泉实验原理及常见气体的性质是解题关键,题目难度不大.

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案| A. | 向Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═2Fe2++Fe3++4H2O | |
| C. | 硅酸钠与二氧化碳的反应:SiO32-+CO2(少量)+H2O═HCO3-+H2SiO3↓ | |
| D. | 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后变蓝:4H++4I-+O2═2I2+2H2O |
| A. | Al2O3 $\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{蒸发}{→}$无水AlCl3 | |
| B. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg | |
| C. | 粗硅$→_{高温}^{Cl_{2}}$SiCl4$→_{高温}^{H_{2}}$Si | |
| D. | AgNO3(aq)$\stackrel{NH_{3}•H_{20}}{→}$Ag(NH3)2OH(aq)$→_{△}^{蔗糖}$Ag |
| A. | FeC12 | B. | Cu2S | C. | Mg3N2 | D. | Na2O2 |
| A. | 0.3 mol/L | B. | 0.6mol/L | C. | 0.9 mol/L | D. | 1.2mol/L |
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Fe3+ | 2.7 | 3.7 |

(1)试剂①可以是AB
A.MgCO3 B.Mg(OH)2C.NaOH D.NH3•H2O
其目的是使溶液的pH升高,使Fe3+转化为氢氧化铁沉淀而分离出去.
(2)图1是该校研究性学习小组设计进行过程③的实验装置图.其中装置A的作用是制备干燥的HCl气体,抑制MgCl2的水解.
(3)为了分析废水中铁元素的含量,先将废水预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?否(填“是”或“否”),请说明理由KMnO4溶液自身可作指示剂.
②下列滴定操作可使测量结果偏大的是ACD.
A.锥形瓶水洗后.用待测液润洗过再装待测液.
B.滴定前读数仰视.滴定后读数俯视.
C.滴定管水洗后.未用标准液洗涤.
D.滴定管装液后尖嘴部位有气泡,滴定后气泡消失
③某同学称取5.000g废水,预处理后在容量瓶中配制成100ml溶液,移取25.00ml试样溶液,用1.000×10-2mol•L-1KMnO4标准溶液滴定.三次实验的实验数据如下表所示.,则废水中铁元素的质量分数是4.480%.
| 实验 编号 | 待测溶液的体积(mL) | 滴定前标液的 体积读数(mL) | 滴定后标液的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 21.22 |
| 2 | 20.00 | 2.21 | 22.19 |
| 3 | 20.00 | 1.50 | 23.48 |
①亚硫酸钠溶液与稀盐酸 ②偏铝酸钠溶液与盐酸 ③二氧化碳与氢氧化钠溶液
④氯化铝与氨水 ⑤碳酸氢钠溶液与澄清石灰水
⑥碳酸氢钙溶液与澄清石灰水 ⑦苯酚钠溶液中通入二氧化碳.
| A. | 2组 | B. | 3组 | C. | 4组 | D. | 5组 |
| A. | 铝钠合金的熔点降低 | |
| B. | 铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na) | |
| C. | m g不同组成的铝钠合金投入足量盐酸中,若放出H2越多,则铝的质量分数越小 | |
| D. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 |
 碱金属元素的单质及其化合物被广泛应用于生产、生活中.
碱金属元素的单质及其化合物被广泛应用于生产、生活中.