题目内容
已知HCl与NaOH完全中和时,两者的物质的量之比为1:1.现有某NaOH溶液100mL,其中含溶质8g,加水将该氢氧化钠溶液稀释至1000mL,取稀释后的NaOH溶液500mL,恰好与100mL的盐酸完全反应,试求这种盐酸溶液溶质的物质的量浓度.
考点:物质的量浓度的相关计算
专题:
分析:稀释前后溶质的物质的量不变,据此计算稀释后的NaOH溶液500mL中含NaOH的物质的量,根据题意可知,100mL的盐酸中所含溶质HCl的物质的量与稀释后的NaOH溶液500mL中含NaOH的物质的量相等,再根据c=
计算盐酸溶液溶质的物质的量浓度.
| n |
| V |
解答:
解:根据稀释前后溶质的物质的量不变,可得稀释后的NaOH溶液500mL中含NaOH的物质的量为:
×
=0.1mol,
根据题意可知,100mL的盐酸中所含溶质HCl的物质的量也为0.1mol,所以盐酸溶液溶质的物质的量浓度为:
=1mol/L,
答:盐酸溶液溶质的物质的量浓度为1mol/L.
| 8g |
| 40g/mol |
| 500mL |
| 1000mL |
根据题意可知,100mL的盐酸中所含溶质HCl的物质的量也为0.1mol,所以盐酸溶液溶质的物质的量浓度为:
| 0.1mol |
| 0.1L |
答:盐酸溶液溶质的物质的量浓度为1mol/L.
点评:本题考查物质的量浓度计算,比较基础,侧重对基础知识的巩固,注意物质的量浓度的理解.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
1,3-丁二烯和2-丁炔分别与氢气反应的热化学方程式如下:
CH2=CH-CH═CH2(g)+2H2(g)→CH3CH2CH2CH3(g)+236.6kJ
CH3-C≡C-CH3(g)+2H2(g)→CH3CH2CH2CH3(g)+272.7kJ
由此不能判断( )
CH2=CH-CH═CH2(g)+2H2(g)→CH3CH2CH2CH3(g)+236.6kJ
CH3-C≡C-CH3(g)+2H2(g)→CH3CH2CH2CH3(g)+272.7kJ
由此不能判断( )
| A、1,3-丁二烯和2-丁炔稳定性的相对大小 |
| B、1,3-丁二烯和2-丁炔分子储存能量的相对高低 |
| C、1,3-丁二烯和2-丁炔相互转化的热效应 |
| D、一个碳碳叁键的键能与两个碳碳双键的键能之和的大小 |
下列说法不正确的是( )
| A、乙醇、乙烯都可被酸性高锰酸钾溶液氧化 |
| B、乙烯、苯都可与溴水发生加成反应 |
| C、乙醇、乙酸都可以发生酯化反应 |
| D、淀粉、油脂都可以发生水解反应 |
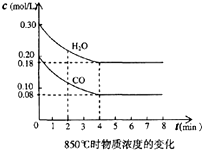 在体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
在体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应: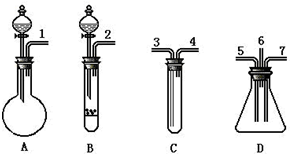 根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示:
根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示:
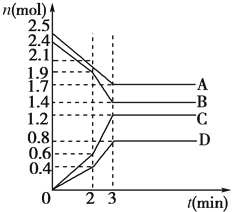 在某一容积为2L的密闭容器中,A、B、C、D四种气体物质的量(n)随时间(t)的变化曲线如图所示:
在某一容积为2L的密闭容器中,A、B、C、D四种气体物质的量(n)随时间(t)的变化曲线如图所示: