题目内容
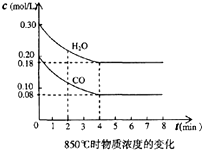 在体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
在体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)?CO2(g)十H2 (g)△H<0,CO和H2O浓度变化如图,
(1)3min-4min之间反应处于
(2)要使反应在8min后,平衡向逆方向移动,可采取的措施是
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)求出850℃时,该反应的平衡常数和CO的平衡转化率(写出详细计算过程)
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素,化学平衡的计算
专题:化学平衡专题
分析:(1)根据3min-4min之间,CO和H2O浓度还在变化,未达平衡状态;
(2)根据外界条件的改变对化学平衡移动的影响判断;
(3)计算出平衡时各物质浓度,利用化学平衡常数表达式和CO转化率表达式计算.
(2)根据外界条件的改变对化学平衡移动的影响判断;
(3)计算出平衡时各物质浓度,利用化学平衡常数表达式和CO转化率表达式计算.
解答:
解:(1)3min-4min之间,CO和H2O浓度还在变化,未达平衡状态,故答案为:不平衡;
(2)a.增加水蒸气,化学平衡向正反应方向移动,化学反应速率增大;
b.正反应放热,降低温度,化学平衡向右移动,化学反应速率减小;
c.使用催化剂,化学平衡不移动;
d.增加氢气浓度,化学平衡向逆反应方向移动,化学反应速率增大;
根据以上分析可知,平衡向逆方向移动,可采取的措施选择d;反应速率降低,平衡向正方向移动,可采取的措施选择b,
故答案为:d;b;
(3)850℃时,转化的CO为0.12mol/L,则
CO(g) 十 H2O(g)?CO2(g) 十 H2 (g)
初始浓度(mol/L) 0.2 0.3 0 0
变化浓度(mol/L) 0.12 0.12 0.12 0.12
平衡浓度(mol/L) 0.08 0.18 0.12 0.12
化学平衡常数K=
=
=1,CO的转化率为:
×100%=60%,
答:该反应的平衡常数为1,CO的平衡转化率为60%.
(2)a.增加水蒸气,化学平衡向正反应方向移动,化学反应速率增大;
b.正反应放热,降低温度,化学平衡向右移动,化学反应速率减小;
c.使用催化剂,化学平衡不移动;
d.增加氢气浓度,化学平衡向逆反应方向移动,化学反应速率增大;
根据以上分析可知,平衡向逆方向移动,可采取的措施选择d;反应速率降低,平衡向正方向移动,可采取的措施选择b,
故答案为:d;b;
(3)850℃时,转化的CO为0.12mol/L,则
CO(g) 十 H2O(g)?CO2(g) 十 H2 (g)
初始浓度(mol/L) 0.2 0.3 0 0
变化浓度(mol/L) 0.12 0.12 0.12 0.12
平衡浓度(mol/L) 0.08 0.18 0.12 0.12
化学平衡常数K=
| c(CO2) ?c(H2) |
| c(CO)? c(H2O) |
| 0.12 mol/L×0.12 mol/L |
| 0.08 mol/L×0.18 mol/L |
| 0.12mol/L |
| 0.20mol/L |
答:该反应的平衡常数为1,CO的平衡转化率为60%.
点评:本题考查化学平衡常数及影响因素、影响化学平衡的因素、化学平衡图象与计算等,难度中等.

练习册系列答案
相关题目
分类是学习和研究化学的一种常用的科学方法.下列分类合理的是( )
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③同位素:1H、2H、3H;干冰、液氯都是非电解质
④电解质:明矾、冰醋酸、纯碱; 同素异形体:C60、金刚石、石墨
⑤根据分散系的稳定性大小将混合物分为胶体、溶液和浊液.
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③同位素:1H、2H、3H;干冰、液氯都是非电解质
④电解质:明矾、冰醋酸、纯碱; 同素异形体:C60、金刚石、石墨
⑤根据分散系的稳定性大小将混合物分为胶体、溶液和浊液.
| A、只有②④ | B、只有②③⑤ |
| C、只有①②④ | D、只有②③⑤ |
下列溶液具有漂白性的是( )
| A、新制氯水 | B、氨水 |
| C、石灰水 | D、苏打水 |
利用下列装置(部分仪器已省略),能顺利完成对应实验的是( )
A、 验室制取乙烯 |
B、 石油的分馏实验 |
C、 实验室制取乙炔并收集 |
D、 利用酒精萃取碘水中的I2单质 |


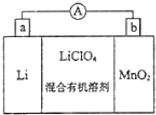 锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题: 该蓄电池结构和反应原理如图,其中放电时是一个
该蓄电池结构和反应原理如图,其中放电时是一个