题目内容
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH 2K2FeO4+6KCl+8H2O。下列有关该反应说法正确的是
2K2FeO4+6KCl+8H2O。下列有关该反应说法正确的是
A.该反应是置换反应 B.钾元素化合价降低
C.Fe(OH)3发生氧化反应 D.Cl2是还原剂
C
【解析】
试题分析:反应中铁元素的化合价从+3价升高到+6价,发生氧化反应,氯元素化合价从0价降低到-1价,发生还原反应,该反应是氧化还原反应,不是置换反应,A错误;钾元素化合价不变,B错误;Fe(OH)3发生氧化反应,C正确;Cl2是氧化剂,D错误;答案选C。
考点:氧化还原反应

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案下列电离方程式中,书写正确的是
A.Na2SO4=2Na++SO4-2 B.Ba(OH)2=Ba2++(OH-)2
C.KClO3=K++Cl-+3O2- D.Fe2(SO4)3=2Fe3++3SO42-
(5分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c1 | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸: 。
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2 mol·L-1? (选填“是”或“否”)。
(3)从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。
(4)写出丁组实验所得混合溶液中下列算式的精确结果(不能做近似计算)。
①c(Na+)-c(A-)= mol·L-1;
②c(OH-)-c(HA)= mol·L-1。
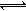 3C(s)+2D(g);ΔH>0。下图所示为正逆反应速率(v)与时间(t)关系的示意图,
3C(s)+2D(g);ΔH>0。下图所示为正逆反应速率(v)与时间(t)关系的示意图,