题目内容
15.如图烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )
| A. | ②①③④ | B. | ④③②① | C. | ④②①③ | D. | ③②④① |
分析 ①铁为活泼金属,可发生的是化学腐蚀,
②铁做负极,锡做正极,电解质溶液为海水,则负极铁发生氧化反应,正极发生还原反应,
③锌比铁活泼,做原电池的负极而被氧化,铁做正极被保护,
④铁做负极被腐蚀,铜做正极,
电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护.
解答 解:根据图知:①铁为活泼金属,可发生的是化学腐蚀,
②B为原电池装置,Fe较活泼为原电池的负极,发生氧化反应被腐蚀,
③Zn比Fe活泼,形成原电池反应,锌被氧化,铁做正极被保护,
④铁做负极发生氧化反应被腐蚀,铜做正极;
①发生化学腐蚀,②发生电化学腐蚀,③锌比铁活泼,铁做原电池的正极而被保护,④发生电化学腐蚀,其中两个电极活泼些相差越大铁腐蚀速率越大,②④都是铁做负极被腐蚀,④中电极金属活泼性相差大所以腐蚀速率快,
电化学腐蚀的速率大于化学腐蚀的速率,腐蚀速率由快到慢的顺序为④>②>①>③,
故选:C.
点评 本题考查金属的电化学腐蚀与防护,题目难度不大,注意金属的电化学腐蚀与化学腐蚀的区别,以及比较金属腐蚀快慢的方法.

练习册系列答案
相关题目
5.在海带提碘的实验过程中发生的下列变化,其中叙述正确的是( )
| A. | 燃烧时只发生了物理变化 | |
| B. | 氧化时,氯元素从化合态转变为游离态 | |
| C. | 用CCl4萃取碘的过程中,没有化学变化发生 | |
| D. | 可以用四氯化碳或酒精作为萃取剂将碘单质从碘水中萃取出来 |
6.下列分子或离子在指定溶液中能大量共存的是( )
| A. | 酸性溶液中:Cl-、SO42-、Fe3+、Mg2+ | |
| B. | 使酚酞变红的溶液中:Na+、CO32-、Cl-、Al3+ | |
| C. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| D. | 1.0 mol•L-1的CuSO4溶液:H+、Ba2+、AlO2-、NH3•H2O |
10.在实验室中,常用 KMnO4代替 MnO2与浓盐酸反应制取氯气,其反应的化学方程式为2KMnO4+16HCl(浓)=2MnCl2+5Cl2↑+2KCl+8H2O,下列叙述中正确的是( )
| A. | 反应中 KMnO4被氧化 | |
| B. | 氧化产物与还原产物的物质的量之比为 2:5 | |
| C. | 每生成 1 mol Cl2时,反应中转移的电子为 2 mol | |
| D. | 每消耗 16 molHCl 时,其中作氧化剂的 HCl 是 10 mol |
7.以下物质间的转化通过一步反应不能实现的是( )
| A. | NH3→NO2 | B. | C→CO2 | C. | Na2O2→Na2CO3 | D. | S→SO2 |
4.某消毒液的主要成分为NaClO,还含有一定量的NaOH,常温下分别取该消毒液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
| A. | 通入过量SO2:H+、Cl-、ClO-、HSO3- | |
| B. | 通入过量FeSO4溶液:Fe2+、H+SO42-、ClO- | |
| C. | 加入少量Al2(SO4)3溶液:Al3+、H+、ClO-、SO42- | |
| D. | 加入少量Na2O2固体:Na+、Cl-、ClO-、OH- |
5.完成下列问题.
I.已知甲和乙为中学常见金属单质,丙和丁为常见气体单质,A~E为常见化合物;A为淡黄色固体,常温下B为液体,C的焰色反应为黄色.试回答下列问题:
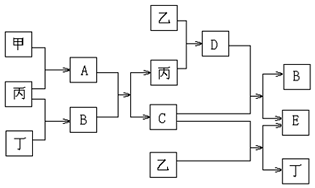
(1)A和 E的化学式分别为Na2O2、NaAlO2;
(2)A+B→C+丙的化学方程式:2Na2O2+2H2O=4NaOH+O2↑;
(3)D+C→B+E的离子方程式:2OH-+Al2O3=2AlO2-+H2O;
(4)1mol甲和1mol乙混合投入足量的B中,在标准状况下最多能产生44.8L丁气体.
II.在标准状况下,取甲、乙、丙各30.mL相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝混合物,得下表中有关数据(反应前后溶液体积不发生变化).
(1)甲组实验中,盐酸过量(填“过量”“适量”或“不足”);乙组实验中,盐酸不足(填“过量”“适量”或“不足”)
(2)盐酸的物质的量浓度为1mol/L..
(3)混合物中Mg和Al的物质的量之比为1:1.
I.已知甲和乙为中学常见金属单质,丙和丁为常见气体单质,A~E为常见化合物;A为淡黄色固体,常温下B为液体,C的焰色反应为黄色.试回答下列问题:

(1)A和 E的化学式分别为Na2O2、NaAlO2;
(2)A+B→C+丙的化学方程式:2Na2O2+2H2O=4NaOH+O2↑;
(3)D+C→B+E的离子方程式:2OH-+Al2O3=2AlO2-+H2O;
(4)1mol甲和1mol乙混合投入足量的B中,在标准状况下最多能产生44.8L丁气体.
II.在标准状况下,取甲、乙、丙各30.mL相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝混合物,得下表中有关数据(反应前后溶液体积不发生变化).
| 实验序号 | 甲 | 乙 | 丙 |
| 混合物质量/mg | 255 | 385 | 459 |
| 气体体积/mL | 280 | 336 | 336 |
(2)盐酸的物质的量浓度为1mol/L..
(3)混合物中Mg和Al的物质的量之比为1:1.
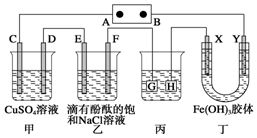 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.