��Ŀ����
����Ŀ������˵������ȷ���ǣ� ��
A.25��ʱij��Һ��ˮ�������c(H+)��1.0��1012 mol��L1����pHһ����12
B.ij�¶��£���ˮ��ͨ��CO2������CO2��ͨ�룬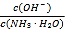 ��������
��������
C.���º����£���ӦX(g)��3Y(g) ![]() 2Z(g)����ʼ����3 mol X��3 mol Y����X�������������ʱ����Ӧ�ﵽƽ��
2Z(g)����ʼ����3 mol X��3 mol Y����X�������������ʱ����Ӧ�ﵽƽ��
D.ij�¶��£���pH��6������ˮ�м���NaHSO4���壬�����¶Ȳ��䣬�����Һ��pHΪ2�����¶��¼�������pH��10��NaOH��Һ��ʹ��Ӧ�����Һǡ�ó�����
���𰸡�D
��������
A. ��Ȼ��ˮ������c��H+��=1.0��10-12mol/L������ˮ������c��OH-��==1.0��10-12mol/L����c��H+����c��OH-��=1.0��10-14mol/L������ԭ������Һ��c��H+��=1.0��10-2mol/L����c��OH-��=1.0��10-2mol/L������Һ���ܳ���ǿ���ǿ���ԣ�ǿ��ʱpH=2��ǿ��ʱpH=12����A����
B. NH3��H2O ![]() NH4����OH-��ͨ��CO2ƽ�������ƶ���c(NH4+)��������ƽ�ⳣ�����䣬��
NH4����OH-��ͨ��CO2ƽ�������ƶ���c(NH4+)��������ƽ�ⳣ�����䣬�� =
= ���ϼ�С����B����
���ϼ�С����B����
C. ���º����£���ӦX(g)��3Y(g) ![]() 2Z(g)����ʼ����3 mol X��3 mol Y��������ʽ�����֪��X���������һֱ��50%����C����
2Z(g)����ʼ����3 mol X��3 mol Y��������ʽ�����֪��X���������һֱ��50%����C����
D. ����ˮ��pH��6������Kw=1��10-12��Ӧ��������Ũ��Ϊ0.01mol L-1������������Һ����Ӧ��������pH=10��NaOH��Һ����ʹ����Һǡ�ó����ԣ���D��ȷ��
��ȷ����D��

 ״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�����Ŀ���ڼס��ҡ����������º��ݵ��ܱ������У��ֱ������������̿��һ������NO�����з�ӦC(s)+2NO(g)N2(g)+CO2(g)����ø�������c(NO)�淴Ӧʱ��t�ı仯��������ʾ������˵����ȷ���ǣ� ��
���� �� | t/min c/mol��L-1 | 0 | 40 | 80 | 120 | 160 |
��(400��) | c(NO) | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
��(400��) | c(NO) | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
��(T��) | c(NO) | 2.00 | 1.40 | 1.10 | 1.10 | 1.10 |
A.�ﵽƽ��״̬ʱ��2v��(NO)=v��(N2)
B.����̿���������ٸı䲻��˵����Ӧ�Ѵ�ƽ��״̬
C.�������У��ӷ�Ӧ��ʼ������ƽ��ʱ��ƽ����Ӧ����Ϊv(NO)>0.01125mol��L-1��min-1
D.�ɱ������ݿ�֪��T<400��