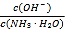题目内容
【题目】全钒液流电池充电时间短,续航能力强,其充放电原理为VO2++V2++2H+![]() VO2++V3++H2O以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH和H2SO4示意图如下。下列说法错误的是( )
VO2++V3++H2O以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH和H2SO4示意图如下。下列说法错误的是( )

A.全钒液流电池放电时,正极的电极反应式为VO2++2H++e-=VO2++H2O
B.图中a电极为阴极,N物质是H2
C.全钒液流电池充电时,V3+被氧化为VO2+
D.电解时,b电极的反应式为SO32-+H2O-2e-=SO42-+2H+
【答案】C
【解析】
由VO2++V2++2H+![]() VO2++V3++H2O,可知,放电时V2+在负极失去电子,VO2+在正极上得到电子,原电池中阳离子向正极移动;充电时阴极发生还原反应,与原电池负极相连,用石墨电极电解Na2SO3溶液,可得到NaOH 和H2SO4,在阳极上是亚硫酸根和氢氧根离子失电子,氢离子浓度增大,硫酸根移向该电极,产生硫酸,在阴极上是氢离子得电子的还原反应,氢氧根离子浓度增加,钠离子移向该电极,会产生氢氧化钠,据此回答。
VO2++V3++H2O,可知,放电时V2+在负极失去电子,VO2+在正极上得到电子,原电池中阳离子向正极移动;充电时阴极发生还原反应,与原电池负极相连,用石墨电极电解Na2SO3溶液,可得到NaOH 和H2SO4,在阳极上是亚硫酸根和氢氧根离子失电子,氢离子浓度增大,硫酸根移向该电极,产生硫酸,在阴极上是氢离子得电子的还原反应,氢氧根离子浓度增加,钠离子移向该电极,会产生氢氧化钠,据此回答。
A. 放电时,正极发生还原反应,电极反应为:VO2++e-+2H+=VO2++H2O,故A正确;
B. 在阴极上是氢离子得电子的还原反应,氢氧根离子浓度增加,钠离子移向该电极,会产生氢氧化钠,a电极为阴极,N物质是H2,故B正确;
C. 钒液流电池充电时,V3+被还原为V2+,故C错误;
D. 电解时,在阳极上是亚硫酸根和氢氧根离子失电子,氢离子浓度增大,硫酸根移向该电极,产生硫酸,b电极是阳极,该电极的反应式为SO32+H2O2e=SO42+2H+,故D正确;
题目要求选择错误的,故选C。

练习册系列答案
相关题目