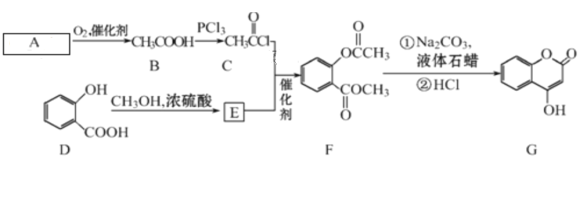
题目内容
【题目】B卷题.某兴趣小组为了提高电池的效率,设计了下图所示的原电池。
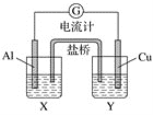
请回答下列问题:
(1)若X是AlCl3溶液,Y是稀硫酸,请你写出电极反应式和总反应式:
Al片上的电极反应式__________________________________,
Cu片上的电极反应式__________________________________,
总反应的方程式:________________________________________________。
(2)若X是浓硝酸,Y是NaCl溶液,请你写出电极名称及电极反应:
Al片上的电极反应式__________________________________,
Cu片上的电极反应式__________________________________,
总反应的方程式:________________________________________________。
【答案】2Al-6e-=2Al3+ 6H++6e-=3H2↑ 2Al+6H+==2Al3++3H2↑(离子和化学方程式均给分) 2NO3-+4H++2e-=2NO2↑+2H2O Cu-2e-=Cu2+ Cu+2NO3-+4H+= Cu2++2NO2↑+2H2O(离子和化学方程式均给分)
【解析】
(1)、该原电池中,Al易失电子发生氧化反应而作负极、Cu作正极,负极上Al失电子生成铝离子进入溶液,所以负极反应式为:2Al-6e-=2Al3+,正极是氢离子得电子产生氢气,电极反应式为:6H++6e-=3H2↑;
故答案为:2Al-6e-=2Al3+;6H++6e-=3H2↑;2Al+6H+=2Al3++3H2↑;
(2) 、Al和浓硝酸发生钝化现象,Cu和浓硝酸的反应是自发的放热的氧化还原反应,所以能构成原电池,Cu易失电子作负极、Al作正极,正极上硝酸根离子得电子发生还原反应,电极反应式为:2NO3-+4H++2e-=2NO2↑+2H2O,负极反应为:Cu-2e-=Cu2+;
故答案为:2NO3-+4H++2e-=2NO2↑+2H2O;Cu-2e-=Cu2+;Cu+2NO3-+4H+= Cu2++2NO2↑+2H2O。