题目内容
14.指出下列变化能量是怎样转化的:(1)学校燃烧煤煮饭化学能转化为热能,
(2)给手机的电池充电电能转化为化学能.
分析 (1)学校燃烧煤煮饭将化学能转化为热能;
(2)给手机的电池充电将电能转化为化学能.
解答 解:(1)学校燃烧煤煮饭将化学能转化为热能,
故答案为:化学能转化为热能;
(2)给手机的电池充电将电能转化为化学能,
故答案为:电能转化为化学能.
点评 本考点基础性比较强,与课本知识紧密相连,同学们要加强记忆,主要出现在选择题和填空题中.

练习册系列答案
相关题目
5.下列反应是吸热反应的是( )
| A. | HCl+NaOH=NaCl+H2O | B. | 碳酸钙受热分解 | ||
| C. | 镁条溶于盐酸 | D. | CaO+H2O=Ca(OH)2 |
9.羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得.
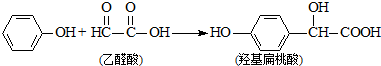
下列有关说法正确的是( )
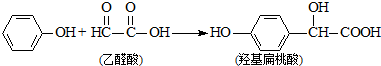
下列有关说法正确的是( )
| A. | 该反应是加成反应 | B. | 苯酚和羟基扁桃酸是同系物 | ||
| C. | 该反应是取代反应 | D. | 乙醛酸不能与 NaOH溶液反应 |
19.四种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
请回答下列问题:
(1)元素Z位于周期表中第三周期,VA族;
(2)这些元素的氢化物中,水溶液碱性最强的是NH3(写化学式);
(3)Y的最高价氧化物的化学式为N2O5.
请回答下列问题:
| X | Y | |
| Z | W |
(2)这些元素的氢化物中,水溶液碱性最强的是NH3(写化学式);
(3)Y的最高价氧化物的化学式为N2O5.
3.碘及其化合物在合成杀菌剂、药物、化学研究等方面具有广泛用途.
(1)为了探究FeCl3溶液和KI溶液的反应是否存在一定的限度,取5mL 0.5mol•L-1 KI溶液,向其中加入0.1mol•L-1 FeCl3溶液1mL,充分反应.下列实验操作能验证该反应是否存在限度的是D
A.再滴加AgNO3溶液,观察是否有黄色沉淀产生
B.再加入CCl4振荡后,观察下层液体颜色是否变为紫红色
C.再加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有白色沉淀产生
D.再加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察溶液是否变成血红色
(2)已知1molH2(g)、1molI2(g)、1molHI(g) 分子中化学键断裂时分别需要吸收436kJ、151kJ、300kJ的能量,则氢气和碘蒸气反应生成HI气体的热化学方程式为H2(g)+I2(g)=2HI(g)△H=-13kJ•mol-1
(3)Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g),在716K,容积固定为2L的密闭容器中,气体混合物中碘化氢的物质的量n(HI)与反应时间t的关系如下表:
0min到20min HI的平均反应速率为0.00225mol•L-1•min-1;
反应到达40min时,剩余HI 的物质的量大于0.82mol(填“>”“<”或“=”).
(1)为了探究FeCl3溶液和KI溶液的反应是否存在一定的限度,取5mL 0.5mol•L-1 KI溶液,向其中加入0.1mol•L-1 FeCl3溶液1mL,充分反应.下列实验操作能验证该反应是否存在限度的是D
A.再滴加AgNO3溶液,观察是否有黄色沉淀产生
B.再加入CCl4振荡后,观察下层液体颜色是否变为紫红色
C.再加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有白色沉淀产生
D.再加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察溶液是否变成血红色
(2)已知1molH2(g)、1molI2(g)、1molHI(g) 分子中化学键断裂时分别需要吸收436kJ、151kJ、300kJ的能量,则氢气和碘蒸气反应生成HI气体的热化学方程式为H2(g)+I2(g)=2HI(g)△H=-13kJ•mol-1
(3)Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g),在716K,容积固定为2L的密闭容器中,气体混合物中碘化氢的物质的量n(HI)与反应时间t的关系如下表:
| t/min | 0 | 20 | 40 |
| n(HI) | 1 | 0.91 | n |
反应到达40min时,剩余HI 的物质的量大于0.82mol(填“>”“<”或“=”).
4.已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 质子数:c>b | B. | 离子半径:X+>Z- | C. | 稳定性:H2Y>HZ | D. | 碱性:XOH>W(OH)3 |