题目内容
2.有19.5克Na2SO4和Na2CO3组成的混合物,向其中加入足量盐酸.产生标准状况下的气体1.12L.试求:(1)样品中Na2CO3的质量为多少?
(2)若向原混合物中加入足量氯化钡溶液,产生沉淀的物质的量为多少摩尔?
分析 (1)生成的气体是二氧化碳,n(CO2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,根据C原子守恒计算n(Na2CO3)=n(CO2)=0.05mol,根据m=nM计算碳酸钠的质量;
(2)向原混合物中加入足量氯化钡溶液,氯化钡和Na2SO4和Na2CO3分别反应生成BaSO4和BaCO3,根据硫酸根离子守恒、碳酸根离子守恒得n(BaSO4)=n(Na2SO4)、n(BaCO3)=n(Na2CO3),所以生成沉淀的物质的量等于n(Na2SO4)+n(Na2CO3),据此分析解答.
解答 解:(1)生成的气体是二氧化碳,n(CO2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,根据C原子守恒计算n(Na2CO3)=n(CO2)=0.05mol,m(Na2CO3)=n(Na2CO3).M(Na2CO3)=0.05mol×106g/mol=5.3g,
答:样品中Na2CO3的质量是5.3g;
(2)则混合物中n(Na2SO4)=$\frac{19.5g-5.3g}{142g/mol}$=0.1mol,
向原混合物中加入足量氯化钡溶液,氯化钡和Na2SO4和Na2CO3分别反应生成BaSO4和BaCO3,根据硫酸根离子守恒、碳酸根离子守恒得n(BaSO4)=n(Na2SO4)、n(BaCO3)=n(Na2CO3),所以生成沉淀的物质的量等于n(Na2SO4)+n(Na2CO3)=0.1mol+0.05mol=0.15mol,
答:若向原混合物中加入足量氯化钡溶液,产生沉淀的物质的量为0.15mol.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间的关系式是解本题关键,注意原子守恒的灵活运用,题目难度不大.

| A. | 碘升华时需要克服分子间作用力,不破坏共价键 | |
| B. | NaCl和HCl溶于水都电离出Cl-,故它们都存在离子键 | |
| C. | 干冰和水分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 离子化合物在任何状态下都能导电 |
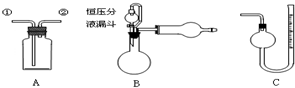
| A. | 装置A从①进气,用排水法可收集NO气体 | |
| B. | 装置A中盛饱和Na2CO3溶液,从①进气除去CO2中混有的HCl | |
| C. | 装置A、B组合,从A中①进气可制备、收集干燥纯净的NH3 | |
| D. | 装置B、C组合,可测定一定质量样品中Zn的氧化程度 |
| A. | NH3 | B. | N2 | C. | CO2 | D. | H2 |
| A. | 此时溶液可能为中性 | |
| B. | 此时溶液中NH4+的浓度一定增大 | |
| C. | 此时NH4+的水解程度一定增大 | |
| D. | 此过程中,溶液中NH3•H2O和NH4+的数目之和一定增大 |
| A. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 | |
| B. | “光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关 | |
| C. | 使用含12C的产品,减少使用含13C或14C的产品符合“促进低碳经济”宗旨 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
| A. | 氢氧化铁胶体制备:向沸水中逐滴加入少量饱和硫酸铁溶液,继续加热煮沸至液体变为红褐色,停止加热 | |
| B. | 用容量瓶配制溶液时,定容时俯视刻度线,所配溶液浓度偏大 | |
| C. | 中和热实验,在操作时应将碱液分多次倒入酸中,以防液体溅出,产生误差 | |
| D. | 萃取碘水中的碘实验时,将碘水倒入分液漏斗,然后再注入乙醇,振荡、静置分层后,下层紫色液体先从下口放出,之后,上层无色液体从上口倒出 |