题目内容
13.下列有关实验原理或操作正确的是( )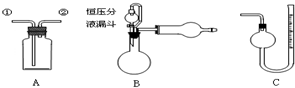
| A. | 装置A从①进气,用排水法可收集NO气体 | |
| B. | 装置A中盛饱和Na2CO3溶液,从①进气除去CO2中混有的HCl | |
| C. | 装置A、B组合,从A中①进气可制备、收集干燥纯净的NH3 | |
| D. | 装置B、C组合,可测定一定质量样品中Zn的氧化程度 |
分析 A.NO不溶于水,可以采用排水法收集NO,收集NO时导气管应该采用“短进长出”原则;
B.二氧化碳和饱和碳酸钠反应生成碳酸氢钠;
C.氨气密度小于空气,应该采用向下排空气法收集;
D.Zn和酸反应生成氢气、ZnO和酸反应生成盐和水,利用C装置测定生成氢气体积,从而确定样品中Zn的质量.
解答 解:A.NO不溶于水,可以采用排水法收集NO,收集NO时导气管应该采用“短进长出”原则,则装置A从①出气,用排水法可收集NO气体,故A错误;
B.二氧化碳和饱和碳酸钠反应生成碳酸氢钠,应该采用饱和的碳酸氢钠溶液除去二氧化碳中的HCl,故B错误;
C.氨气密度小于空气,应该采用向下排空气法收集,则从A中①出气可制备、收集干燥纯净的氨气,故C错误;
D.Zn和酸反应生成氢气、ZnO和酸反应生成盐和水,利用C装置测定生成氢气体积,根据Zn和氢气的关系式计算Zn的质量,从而计算,从而测定一定质量样品中Zn的氧化程度,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及气体收集、除杂等知识点,把握实验原理及物质性质是解本题本题关键,注意AB装置中导气管进出气区别,题目难度不大.

练习册系列答案
相关题目
3.水在273K、1.01×105Pa时可转化为固态,在373K时则又可转化为气态.若分别用S(g)、S(1)、S(s)表示水的气、液、固三种状态的熵值,则下列表达式中,正确的是( )
| A. | S(g)<S(1)<S(s) | B. | S(g)>S(1)>S(s) | C. | S(g)>S(1)=S(s) | D. | S(g)>S(s)>S(1) |
4.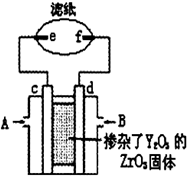 向新型燃料电池的两极分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传到O2-,图中滤纸用含有酚酞的氯化钠溶液浸泡过,c、d、e、f均为惰性电极,工作后e极周围变红,下列叙述正确的是( )
向新型燃料电池的两极分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传到O2-,图中滤纸用含有酚酞的氯化钠溶液浸泡过,c、d、e、f均为惰性电极,工作后e极周围变红,下列叙述正确的是( )
 向新型燃料电池的两极分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传到O2-,图中滤纸用含有酚酞的氯化钠溶液浸泡过,c、d、e、f均为惰性电极,工作后e极周围变红,下列叙述正确的是( )
向新型燃料电池的两极分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传到O2-,图中滤纸用含有酚酞的氯化钠溶液浸泡过,c、d、e、f均为惰性电极,工作后e极周围变红,下列叙述正确的是( )| A. | c极为正极,A处通入甲烷气体 | B. | d极的反应式为O2+2H2O+4e-=4OH- | ||
| C. | 固体电解质中O2-由d极向c极移动 | D. | e极上发生氧化反应,pH上升 |
8.已知0.5L盐酸和硫酸的混合溶液中,含有0.1mol Cl-和0.2mol SO42-,则此溶液中H+的物质的量浓度为( )
| A. | 0.1 mol•L-1 | B. | 1.0 mol•L-1 | C. | 0.3 mol•L-1 | D. | 0.4 mol•L-1 |
18.下列关于原子的构成,正确的是( )
| A. | 由质子和电子构成 | B. | 由原子核和核外电子构成 | ||
| C. | 由质子和中子构成 | D. | 由中子和电子构成 |
5.下面列出了用惰性电极电解不同物质的电极反应式,其中错误的是( )
| A. | 电解饱和BaCl2溶液 阴极:Ba2++2e-=Ba | |
| B. | 电解Cu(NO3)2溶液 阴极:Cu2++2e-=Cu | |
| C. | 电解熔融NaCl阴极:Na++e-=Na | |
| D. | 电解NaOH溶液 阳极:4OH--4e-=2H2O+O2↑ |
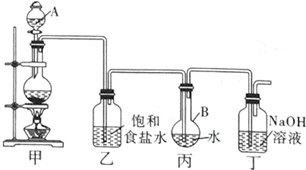
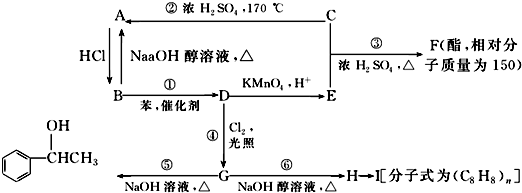
 .
. ;
; .
.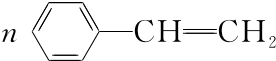 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$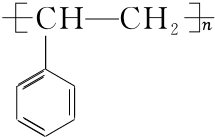 .
.