题目内容
6.钴有+2价、+3价,草酸钴是制备氧化钴的重要原料.在空气中对27.45gCoC2O4•2H2O持续加热,固体的质量变化数据如下表:
| 温度范围/℃ | 120-220 | 300-350 | 450-500 | 高于600 |
| 固体/g | 22.05 | 11.25 | 11.85 | 13.05 |
②450-500℃时得到的固体物质为D(填字母).
A、CoO B、CoC2O3 C、CoO•Co2O4 D.2CoO•Co2O4.
分析 晶体27.45gCoC2O4•2H2O物质的量n=$\frac{27.45g}{183g/mol}$=0.15mol,其中含有的结晶水的质量是0.15×2×18g/mol=5.4g,
①120-220℃时,加热失重质量是$\frac{27.45g}{183g/mol}$.45g-22.05g=5.4g,此时失重的是水的质量;
②结合元素守恒和得确定物质的组成.
解答 解:计算晶体27.45gCoC2O4•2H2O物质的量n=$\frac{27.45g}{183g/mol}$=0.15mol,其中含有的结晶水的质量是0.15×2×18g/mol=5.4g,CoC2O4的质量是27.45g-5.4g=22.05g.
①120-220℃时,加热失重质量是$\frac{27.45g}{183g/mol}$.45g-22.05g=5.4g,此时失重的是水的质量,故CoC2O4•2H2O热分解的生成物是CoC2O4;故答案为:CoC2O4;
②450-500℃时,据钴原子守恒可得质量为8.85,所以含氧元素的质量为3g,即钴原子和氧原子的物质的量之比为4:5,即选D.
故选D.
点评 本题考查了弱酸的电离、盐的水解、离子浓度大小比较、有关方程式的计算等,题目难度中等,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
15.化学与社会、生活密切相关,下列说法正确的是( )
| A. | 石油的分馏、煤的干馏、石油的裂解都是化学变化 | |
| B. | 袋装食品常用生石灰作为食品的抗氧化剂 | |
| C. | 金属焊接时可用饱和NH4Cl溶液作除锈剂 | |
| D. | 泡沫灭火器的内筒为塑料桶,盛有碳酸氢钠溶液;外筒为铁桶,外筒和内筒之间装有硫酸铝溶液 |
1.某化学反应2A(g)?B(g)+D(g)在四种不同条件下进行,B、D起始浓度均为0.反应物A的浓度(c/mol•L-1)随反应时间(t/min)的变化情况如下表:
根据上述数据,下列说法错误的是( )
| 实 验 序 号 | 时间(min) 浓度(mol•L-1) 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
| A. | 该反应是吸热反应,升温正、逆反应速率增大 | |
| B. | 实验3中 c3=1.2 mol•L-1 | |
| C. | 实验1与实验3比较,A的平衡转化率之比为1:2 | |
| D. | 实验2使用了催化剂,在0至10 min内平均速率υ(B)=0.02 mol•L-1•min-1 |
18.下列药品保存时对瓶塞使用错误的是( )
| A. | 保存固体碘时不用铁塞 | B. | 保存汽油时用橡皮塞 | ||
| C. | 保存硫化钠时用橡皮塞 | D. | 保存硝酸时不用橡皮塞 |
 和高分子化合物PCL的合成路线如下:
和高分子化合物PCL的合成路线如下:
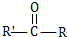 $\stackrel{过氧化物}{→}$
$\stackrel{过氧化物}{→}$ (R、R′代表烃基)
(R、R′代表烃基)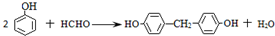 .
. .
.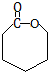 .高分子化合物PCL的结构简式是
.高分子化合物PCL的结构简式是 .
. 、
、 .
.