题目内容
10.下列实验对应的现象与结论均正确的是( )| 选项 | 实验 | 解释或结论 |
| A | 用洁净的Pt蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有Na+,无k+ |
| B | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧 | CO2、H2O与Na2O2反应是放热反应 |
| C | 向溴水中滴入植物油,振荡后,油层显无色 | 溴不溶于油脂 |
| D | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变黄色 | H2O2的氧化性比Fe3+强 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.检验钾离子,应透过蓝色钴玻璃;
B.脱脂棉燃烧应达到着火点;
C.植物油含有不饱和烃基,可与溴水发生加成反应;
D.酸性条件下,硝酸根离子具有强氧化性.
解答 解:A.检验钾离子,应透过蓝色钴玻璃,以滤去黄光,否则不能判断是否含有钾离子,故A错误;
B.用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明反应达到着火点,应为放热反应,故B正确;
C.植物油含有不饱和烃基,可与溴水发生加成反应,油层显无色,故C错误;
D.酸性条件下,硝酸根离子具有强氧化性,不能排除硝酸根离子的干扰,故D错误.
故选B.
点评 本题考查较为综合,涉及离子的检验、元素化合物知识等知识,为高考常见题型,侧重于实验方案的评价能力的考查,注意把握物质的性质,题目难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
20.Q、W、X、Y、Z五种短周期元素在元素周期表中的相对位置如图所示,其中W的单质是一种重要半导体材料.
请按要求回答下列问题:
(1)Y的原子结构示意图为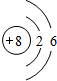 ;举一例说明Z的非金属性比X的非金属性强的事实:酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3.
;举一例说明Z的非金属性比X的非金属性强的事实:酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3.
(2)W、X、Y的原子半径由大到小依次是(填元素符号)r(Si)>r(P)>r(O);W与Z形成的化合物电子式为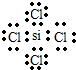 .
.
(3)将Z的单质通入到含等物质的量FeBr2溶液中充分反应的离子方程式为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-.
(4)已知:2Na(s)+1/2Y2(g)=Na2Y(s)△H=-414kJ/mol;2Na(s)+Y2(g)═Na2Y2(s)△H=-511kJ/mol;则Na2Y(s) 转变为Na2Y2(s)的反应一定条件下能自发进行的理由是Na2O(s)+$\frac{1}{2}$O2(g)=Na2O2(s)△H=-97 kJ/mol,而△S<0,△H-T△S在低温下小于0,可自发进行.
将0.2mol Na2Y2加入到100mL1mol/L QZ3中,充分反应的化学方程式为2Na2O2+AlCl3=NaAlO2+3NaCl+O2↑.
(5)R与W同周期,已知:在T℃时Ksp[R(OH)2]的值为4.0×l0-12,则R(OH)2饱和溶液中c(OH-)=2.0×l0-4 mol•L-1.
| Y | ||||
| Q | W | X | Z |
(1)Y的原子结构示意图为
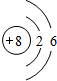 ;举一例说明Z的非金属性比X的非金属性强的事实:酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3.
;举一例说明Z的非金属性比X的非金属性强的事实:酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3.(2)W、X、Y的原子半径由大到小依次是(填元素符号)r(Si)>r(P)>r(O);W与Z形成的化合物电子式为
 .
.(3)将Z的单质通入到含等物质的量FeBr2溶液中充分反应的离子方程式为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-.
(4)已知:2Na(s)+1/2Y2(g)=Na2Y(s)△H=-414kJ/mol;2Na(s)+Y2(g)═Na2Y2(s)△H=-511kJ/mol;则Na2Y(s) 转变为Na2Y2(s)的反应一定条件下能自发进行的理由是Na2O(s)+$\frac{1}{2}$O2(g)=Na2O2(s)△H=-97 kJ/mol,而△S<0,△H-T△S在低温下小于0,可自发进行.
将0.2mol Na2Y2加入到100mL1mol/L QZ3中,充分反应的化学方程式为2Na2O2+AlCl3=NaAlO2+3NaCl+O2↑.
(5)R与W同周期,已知:在T℃时Ksp[R(OH)2]的值为4.0×l0-12,则R(OH)2饱和溶液中c(OH-)=2.0×l0-4 mol•L-1.
18.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 4.6 g乙醇中含有的C-H键的个数为0.6NA | |
| B. | 34 g H2O2中含有的阴离子数为NA | |
| C. | 标准状况下,V L水含有的氧原子个数约为$\frac{V}{22.4}$NA | |
| D. | 1 mol Fe2+与足量的H2O2溶液反应,转移NA个电子 |
15.下列有关物质性质的应用正确的是( )
| A. | 水中加入明矾,可以起到杀菌消毒的作用 | |
| B. | 氧化铝中加入冰晶石,可以起到降低熔点的作用 | |
| C. | 药皂中加入少量苯酚,可以起到增白去污的作用 | |
| D. | 食品包装袋中放入生石灰,可以起到防止月饼等富脂食品氧化变质的作用 |
2.有机化合物Y可以由X合成: ,下列叙述正确的是( )
,下列叙述正确的是( )
 ,下列叙述正确的是( )
,下列叙述正确的是( )| A. | 化合物Y中含有1个手性碳原子 | |
| B. | 用FeCl3溶液可鉴别化合物X和Y | |
| C. | 1molX与溴水反应最多消耗1molBr2 | |
| D. | 在一定条件,化合物X、Y均可以发生缩聚反应和加聚反应 |
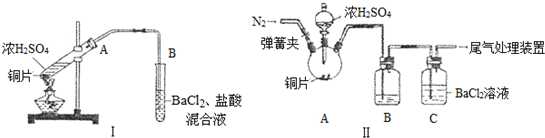
17.实验室以绿矾(FeSO4•7H2O)为铁源制备补铁剂甘氨酸亚铁[(NH2 CH2COO)2 Fe〕.有关物质性质:
实验过程:
I.制备FeCO3:将0.10mol绿矾溶于水中,加入少量铁粉,边搅拌边缓慢加入1.1mol•L-1NH4HCO3溶液200mL.反应结束后过滤并洗涤沉淀.
II.制备(NH2 CH2 COO) 2Fe:实验装置如图(夹持和加热仪器已省略),利用A中反应将C中空气排净,再将上述沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,滴入柠檬酸并加热.反应结束后过滤,滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品.
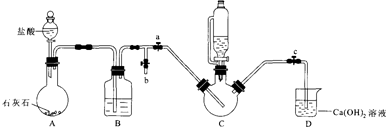
回答下列问题:
(1)实验I中:铁粉的作用是防止二价铁被氧化;生成沉淀的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(2)实验II中:
①装置B中试剂为饱和NaHCO3溶液.
②当C中空气排净后,应停止滴加盐酸,打开止水夹b,关闭止水夹a
③装置D中Ca(OH)2的作用是判断装置中控器是否排尽.
④柠檬酸可调节pH,体系pH与产率的关系如表:
pH过低使产率下降的原因是H+会与NH2CH2COOH反应;柠檬酸的作用还有bc(填序号).
a.作反应终点指示剂 b.防止二价铁被氧化 c.促进FeCO3溶解 d.作催化剂
⑤乙醇的作用是降低甘氨酸亚铁在水中的溶解度,提高产率和纯度.
⑥若产品的质量为m g,则产率为$\frac{m}{20.4}$×100%.
(3)设计实验方案测定产品中二价铁含量(不必描述操作过程的细节):称取一定质量的产品溶于水中,加入适量H2SO4酸化,用KMnO4标准溶液滴定,记录消耗的体积,重复实验2-3次.
(已知产品中存在少量三价铁,且仅二价铁可以在酸性条件下被KMnO4、NaC1O或H2 O2定量快速氧化.)
| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇、两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
I.制备FeCO3:将0.10mol绿矾溶于水中,加入少量铁粉,边搅拌边缓慢加入1.1mol•L-1NH4HCO3溶液200mL.反应结束后过滤并洗涤沉淀.
II.制备(NH2 CH2 COO) 2Fe:实验装置如图(夹持和加热仪器已省略),利用A中反应将C中空气排净,再将上述沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,滴入柠檬酸并加热.反应结束后过滤,滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品.

回答下列问题:
(1)实验I中:铁粉的作用是防止二价铁被氧化;生成沉淀的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(2)实验II中:
①装置B中试剂为饱和NaHCO3溶液.
②当C中空气排净后,应停止滴加盐酸,打开止水夹b,关闭止水夹a
③装置D中Ca(OH)2的作用是判断装置中控器是否排尽.
④柠檬酸可调节pH,体系pH与产率的关系如表:
| 实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
| 产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 5686. |
a.作反应终点指示剂 b.防止二价铁被氧化 c.促进FeCO3溶解 d.作催化剂
⑤乙醇的作用是降低甘氨酸亚铁在水中的溶解度,提高产率和纯度.
⑥若产品的质量为m g,则产率为$\frac{m}{20.4}$×100%.
(3)设计实验方案测定产品中二价铁含量(不必描述操作过程的细节):称取一定质量的产品溶于水中,加入适量H2SO4酸化,用KMnO4标准溶液滴定,记录消耗的体积,重复实验2-3次.
(已知产品中存在少量三价铁,且仅二价铁可以在酸性条件下被KMnO4、NaC1O或H2 O2定量快速氧化.)
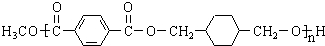 ,某研究小组用芳香烃A为原料合成PCT的合成路线如下.
,某研究小组用芳香烃A为原料合成PCT的合成路线如下.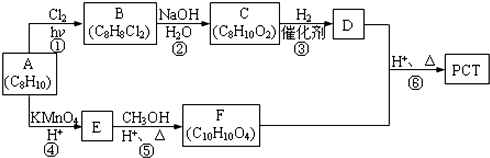
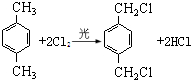 ,A分子中最多有14个原子共平面.
,A分子中最多有14个原子共平面.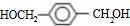 ,反应③的类型是加成反应,
,反应③的类型是加成反应,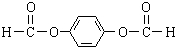 (写结构简式).
(写结构简式).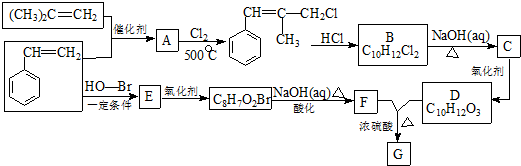
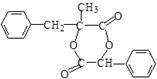 .
.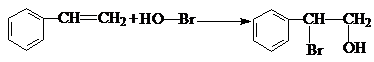 .
.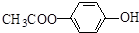 和
和 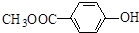 .
.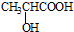 )的合成线路:
)的合成线路: