题目内容
下列所配溶液浓度为1mol/L的是( )
| A、将31g Na2O溶于1升水中 |
| B、常温下,将22.4升HCl溶于水中,形成1升溶液 |
| C、将100mL5mol/L的KNO3溶液加水称释至500mL |
| D、将10mL10mol/L的H2SO4溶液与90mL水混合 |
考点:溶液的配制
专题:
分析:A、Na2O溶于水,与水反应生成NaOH,为NaOH溶液,根据Na2O质量计算NaOH的物质的量,再根据物质的量浓度定义计算判断,注意水的体积不等于溶液的体积;
B、没有标明气体存在的状态是否是标准状况下;
C、根据稀释前后溶质的质物质的量不变,即c(浓)V(浓)=c(稀)V(稀);
D、根据溶液的体积不具有加和性.
B、没有标明气体存在的状态是否是标准状况下;
C、根据稀释前后溶质的质物质的量不变,即c(浓)V(浓)=c(稀)V(稀);
D、根据溶液的体积不具有加和性.
解答:
解:A、根据钠原子守恒可知n(NaOH)=2n(Na2O)=
=0.5mol,但水的体积不等于溶液的体积,所以无法计算,故A错误;
B、没有标明气体存在的状态是否是标准状况下,无法确定气体的物质的量,所以无法计算,故B错误;
C、稀释前后溶质的质物质的量不变,即c(浓)V(浓)=c(稀)V(稀),则100mL×5mol/L=c(稀)×500mL,解得c(稀)=1mol/L,故C正确;
D、将10mL10mol/L的H2SO4溶液与90mL水混合溶液的体积要小于100mL,无法计算,故D错误.
故选C.
| 31g |
| 62g/mol |
B、没有标明气体存在的状态是否是标准状况下,无法确定气体的物质的量,所以无法计算,故B错误;
C、稀释前后溶质的质物质的量不变,即c(浓)V(浓)=c(稀)V(稀),则100mL×5mol/L=c(稀)×500mL,解得c(稀)=1mol/L,故C正确;
D、将10mL10mol/L的H2SO4溶液与90mL水混合溶液的体积要小于100mL,无法计算,故D错误.
故选C.
点评:本题考查物质的量浓度的理解与计算,难度较小,注意物质的量浓度中体积指溶液体积,物质溶于水溶质变化的情况.

练习册系列答案
相关题目
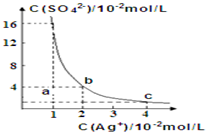 某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示:下列有关Ag2SO4说法正确的是( )
某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示:下列有关Ag2SO4说法正确的是( )| A、含有大量SO42-的溶液中肯定不存在Ag+ |
| B、Ag2SO4的溶度积常数(Ksp)为8×10-4 |
| C、a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
| D、0.02mol?L-1的AgNO3溶液与0.2mol?L-1的Na2SO4溶液等体积混合不会生成沉淀 |
以乙烯为原料合成化合物C的流程如下所示:

(1)请写出B和C中含有的官能团名称分别为: , .
(2)写出A的结构简式 .
(3)①③的反应类型分别为 和 .
(4))写出反应②和④的化学方程式:② ;④ .

(1)请写出B和C中含有的官能团名称分别为:
(2)写出A的结构简式
(3)①③的反应类型分别为
(4))写出反应②和④的化学方程式:②
73gHCl溶解在1L水中(水的密度近似为1g/mL,所得溶液的密度为ρg/ml,质量分数为ω,物质的量浓度为c,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
| A、所得溶液的物质的量浓度为c=2mol/L | ||
| B、所得溶液中含有2NA个HCl分子 | ||
| C、73g HCl气体占有的体积为44.8L | ||
D、所得溶液的质量分数:ω=
|



