题目内容
11. 已知A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有2个单电子;C占整个地壳质量的48.6%,是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子,是热和电最佳导体之一,是唯一的能大量天然产出的金属;D与F不同周期,但最外能层电子数相等.
已知A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有2个单电子;C占整个地壳质量的48.6%,是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子,是热和电最佳导体之一,是唯一的能大量天然产出的金属;D与F不同周期,但最外能层电子数相等.(1)写出基态D原子的价电子排布式3s1.
(2)A、B、C三种元素第一电离能最大的是N(用元素符号表示)其原因是同一周期随着原子序数的递增,元素的第一电离能总体呈现增大趋势,N原子原子2p轨道为半满稳定状态,能量较低.
(3)A、C两元素形成的化合物AC2的分子空间构型直线形.与 AC2互为等电子体的粒子的化学式N2O,NO2+(分子和离子各写一种).
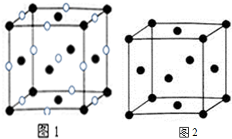
(4)D、E形成的一种离子化合物,在图1晶胞结构图中黑球表示E的位置,白球表示D的位置,已知该晶胞的边长为n cm,阿伏加德罗常数为NA,求晶胞的密度ρ=$\frac{234}{{n}^{3}•{N}_{A}}$g/cm3(用含a、NA的计算式表示).
(5)由F原子形成的晶胞结构如图2,F原子的半径为r,列式表示F原子在晶胞中的空间利用率$\frac{\sqrt{2}π}{6}$(不要求计算结果).
分析 A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有2个单电子,原子核外电子排布式为1s22s22p2,故A为碳元素;C占整个地壳质量的48.6%,是地壳中含量最多的元素,则C为O元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性,则E为Cl;F位于ds区,最外能层有单电子,是热和电最佳导体之一,是唯一的能大量天然产出的金属,F为Cu;D与F不同周期,但最外能层电子数相等,D的原子序数大于氧、小于Cl,可知D为Na.
(1)D为Na,处于第三周期IA族;
(2)同一周期随着原子序数的递增,元素的第一电离能总体呈现增大趋势,N原子原子2p轨道为半满稳定状态,能量较低;
(3)A、C两元素形成的化合物CO2的分子空间构型为直线形,原子数目相等、价电子总数也相等的微粒互为等电子体;
(4)利用均摊法计算晶胞中氯离子、钠离子数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度;
(5)根据均摊法计算晶胞中F原子数目,进而计算晶胞中F原子总体积,面对角线上的原子相邻,晶胞棱长为面对角线长度的$\frac{\sqrt{2}}{2}$倍,计算晶胞体积,F原子在晶胞中的空间利用率=$\frac{原子总体积}{晶胞体积}$.
解答 解:A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有2个单电子,原子核外电子排布式为1s22s22p2,故A为碳元素;C占整个地壳质量的48.6%,是地壳中含量最多的元素,则C为O元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性,则E为Cl;F位于ds区,最外能层有单电子,是热和电最佳导体之一,是唯一的能大量天然产出的金属,F为Cu;D与F不同周期,但最外能层电子数相等,D的原子序数大于氧、小于Cl,可知D为Na.
(1)D为Na,价电子排布式为3s1,故答案为:3s1;
(2)同一周期随着原子序数的递增,元素的第一电离能总体呈现增大趋势,N原子原子2p轨道为半满稳定状态,能量较低,第一电离能大于氧元素的,
故答案为:N;同一周期随着原子序数的递增,元素的第一电离能总体呈现增大趋势,N原子原子2p轨道为半满稳定状态,能量较低;
(3)A、C两元素形成的化合物CO2的分子空间构型为直线形,与CO2互为等电子体的粒子的化学式有N2O、NO2+ 等,
故答案为:N2O、NO2+;
(4)E为Cl、D为Na,晶胞中氯离子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,钠离子数目为1+12×$\frac{1}{4}$=4,则晶胞质量为4×$\frac{58.5}{{N}_{A}}$g,晶胞的边长为n cm,则晶胞的密度ρ=4×$\frac{58.5}{{N}_{A}}$g÷(n cm)3=$\frac{234}{{n}^{3}•{N}_{A}}$g/cm3,
故答案为:$\frac{234}{{n}^{3}•{N}_{A}}$;
(5)晶胞中F原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,F原子的半径为r,则F原子总体积为4×$\frac{4}{3}$πr3,晶胞棱长为4r×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$r,则晶胞体积为(2$\sqrt{2}$r)3,则F原子在晶胞中的空间利用率$\frac{4×\frac{4}{3}π{r}^{3}}{(2\sqrt{2}r)^{3}}$=$\frac{\sqrt{2}π}{6}$,
故答案为:$\frac{\sqrt{2}π}{6}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、空间构型、等电子体、晶胞计算等,掌握均摊法进行晶胞有关计算,注意同周期第一电离能异常情况.

 名校课堂系列答案
名校课堂系列答案| A. | 工业上生产玻璃、水泥、漂白粉均需要用石灰石为原料 | |
| B. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 | |
| C. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| D. | 司母戊鼎、定远舰甲板、有机玻璃等原材料属于合金 |
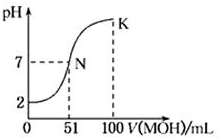 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )| A. | HA为一元强酸,MOH为一元弱碱 | |
| B. | 滴入MOH溶液的体积为50 mL时,c(M+)>c(A-) | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | K点时,c(MOH)+c(M+)=0.02 mol•L-1 |
| A. | X与Y形成的两种化合物中阴阳离子个数比为1:2 | |
| B. | Y分别与Z、W、R以两种元素组成的常见化合物有5种 | |
| C. | Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物熔沸点低 | |
| D. | Z、W、R的最高价氧化物对应水化物的酸性强弱顺序是R>W>Z |
 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.(1)卤族元素位于周期表的p区;溴的价电子排布式为4s24p5.
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I.
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 |
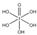 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-.I3-离子的中心原子周围σ键电子对对数为2,孤电子对对数为3,I3-离子的空间构型为直线形,
与KI3类似的,还有CsICl2等.已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,
则它按下列A式发生.
A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(6)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3,写出一个ClO2-的等电子体Cl2O或OF2.
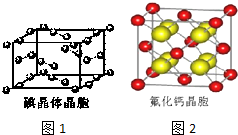
(7)如图1为碘晶体晶胞结构.有关说法中正确的是A.
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(8)已知CaF2晶体(见图2)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}{a}^{3}ρ{N}_{A}}{2}$.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
③根据H2SO3的电离常数数据,判断NaHSO3溶液显酸性还是显碱性?
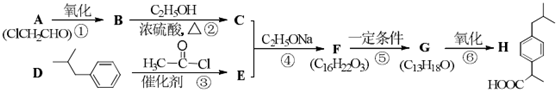
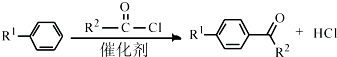 (R1、R2代表烷基)
(R1、R2代表烷基)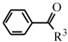 +ClCH2COOR4+R4ONa→
+ClCH2COOR4+R4ONa→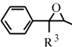 COOR4+R4OH+NaCl(R3、R4代表烷基)
COOR4+R4OH+NaCl(R3、R4代表烷基)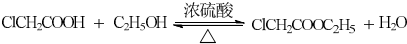 .
. .
.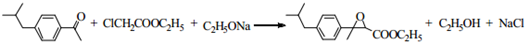 .
.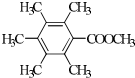 、
、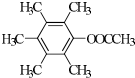 、
、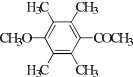 .
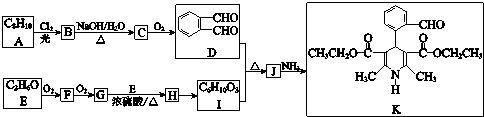
.
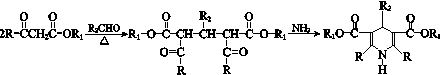
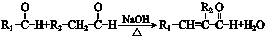 (R、R1、R2表示氢原子或烃基)
(R、R1、R2表示氢原子或烃基)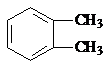 .
.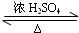 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.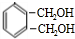 +O2 $→_{△}^{催化剂}$
+O2 $→_{△}^{催化剂}$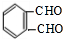 +2H2O.
+2H2O.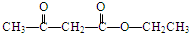 .
.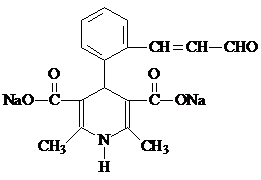 .
.