题目内容
某课外实验小组设计的下列实验不合理的是( )


| A、装置①制备并观察氢氧化亚铁 |
| B、装置②证明过氧化钠与水反应放热 |
| C、装置③比较KMnO4、Cl2、I2的氧化性强弱 |
| D、装置④测定盐酸的浓度 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.生成氢气将装置中空气排出,且使硫酸亚铁与NaOH反应,防止生成的硫酸亚铁被氧化;
B.脱脂棉燃烧,则反应为放热反应;
C.浓盐酸与高锰酸钾反应生成氯气,氯气与KI反应生成碘,结合氧化剂的氧化性大于氧化产物的氧化性分析;
D.NaOH溶液不能盛放在酸式滴定管中.
B.脱脂棉燃烧,则反应为放热反应;
C.浓盐酸与高锰酸钾反应生成氯气,氯气与KI反应生成碘,结合氧化剂的氧化性大于氧化产物的氧化性分析;
D.NaOH溶液不能盛放在酸式滴定管中.
解答:
解:A.生成氢气将装置中空气排出,且使硫酸亚铁与NaOH反应,防止生成的硫酸亚铁被氧化,图中装置合理,故A正确;
B.脱脂棉燃烧,则反应为放热反应,则图中装置可证明过氧化钠与水反应放热,故B正确;
C.浓盐酸与高锰酸钾反应生成氯气,氯气与KI反应生成碘,由氧化剂的氧化性大于氧化产物的氧化性可知,KMnO4、Cl2、I2的氧化性由强到弱,故C正确;
D.NaOH溶液不能盛放在酸式滴定管中,应选用碱式滴定管,故D错误;
故选D.
B.脱脂棉燃烧,则反应为放热反应,则图中装置可证明过氧化钠与水反应放热,故B正确;
C.浓盐酸与高锰酸钾反应生成氯气,氯气与KI反应生成碘,由氧化剂的氧化性大于氧化产物的氧化性可知,KMnO4、Cl2、I2的氧化性由强到弱,故C正确;
D.NaOH溶液不能盛放在酸式滴定管中,应选用碱式滴定管,故D错误;
故选D.
点评:本题考查化学实验方案的评价,为高频考点,涉及物质的制备、氧化性的比较、中和滴定及放热反应的实验等,综合性较强,侧重反应原理及物质性质的考查,注意选项A为解答的易错点,题目难度不大.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、氢氧化钡与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
| B、Al2O3溶于盐酸中:O2-+2H+=H2O |
| C、氯化铝溶液中加入少量氨水:Al3++3OH-=Al(OH)3↓ |
| D、氯气与水反应 Cl2+H2O?H++Cl-+HClO |
室温下,各离子组一定能大量共存的是( )
| A、强碱性溶液中:K+、Al3+、Cl-、SO42- |
| B、pH=0的溶液中:Na+、Fe3+、NO3-、SO42- |
| C、含有1mol?L-1Fe3+的溶液中:K+、Mg2+、I-、NO3 |
| D、由水电离的c(H+)=1×10-14的溶液中:K+、Ca2+、Cl-、HCO3 |
对于达到平衡的化学反应:C(s)+H2O(g)?CO(g)+H2(g)(正反应为吸热反应),下列叙述正确的是( )
| A、升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| B、加入水蒸气使容器压强增大,平衡向逆反应方向移动 |
| C、加入固体碳,平衡向正反应反应方向移动 |
| D、扩大容器的容积,平衡向正反应方向移动 |
下列化学用语或模型表示不正确的是( )
| A、中子数为14的硅原子:1428Si |
B、CH4分子的比例模型 |
C、聚乙烯的结构简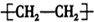 |
| D、次氯酸分子的结构式:H-O-Cl |
下列叙述正确的是( )
| A、向明矾溶液中加入过量NaOH溶液会产生大量白色沉淀 |
| B、Na2O2用作呼吸面具的供氧剂 |
| C、氯水中通入SO2后溶液的酸性减弱 |
| D、N2与O2在放电条件下直接化合生成NO2 |
