题目内容
3.化学与生活密切相关,下列说法正确的是( )| A. | 漂白粉长期放置在空气中会被空气中的氧气氧化而变质 | |
| B. | 河水中有许多杂质和有害细菌,加入K2FeO4可以消毒杀菌除杂 | |
| C. | 辽宁舰上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| D. | 利用加热的方法杀死人体内感染的埃博拉病毒 |
分析 A.漂白粉长期放置在空气中,与水、二氧化碳反应;
B.K2FeO4具有强氧化性,还原产物为铁离子;
C.特种钢缆,为合金材料;
D.高温可使蛋白质发生变性.
解答 解:A.漂白粉长期放置在空气中,与水、二氧化碳反应,生成HClO光照分解,漂白粉与氧气不反应,故A错误;
B.K2FeO4具有强氧化性,可消毒杀菌,且还原产物水解生成胶体可吸附水中悬浮杂质,故B正确;
C.特种钢缆,为合金材料,不属于新型无机非金属材料,故C错误;
D.高温可使蛋白质发生变性,但不能利用加热的方法杀死人体内感染的埃博拉病毒,人体中蛋白质加热下发生变性,故D错误;
故选B.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,注意生活与化学的联系,题目难度不大.

练习册系列答案
相关题目
13.常温下,下列离子一定能大量存在于相应溶液中的是( )
| A. | 电解时阴极上无金属析出的溶液:Al3+、Zn2+、Cl-、SO42- | |
| B. | 加入铁粉有氢气生成的溶液:Mg2+、K+、NO3- | |
| C. | 通入SO2后无沉淀生成的溶液:Ba2+、Fe3+、Cl-、NO3- | |
| D. | 常温下,水电离出的c(H+)=1×10-12mol/L的溶液中:Cl-、I-、Na+、K+ |
14.一定条件下,在体积一定的密闭容器中加入1mol N2和3mol H2发生反应:N2+3H2$\frac{\underline{\;高温高压\;}}{催化剂}$2NH3(正反应是放热反应).下列有关说法正确的是( )
| A. | 升高温度能加快反应速率 | |
| B. | 1mol N2和3mol H2的总能量低于2mol NH3的总能量 | |
| C. | 达到化学反应限度时,生成2molNH3 | |
| D. | 平衡时各组分含量之比一定等于3:1:2 |
11.阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图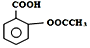 所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )
所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )
 所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )
所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )| A. | 该化合物的分子式为C9H10O4 | |
| B. | 乙酰水杨酸的所有原子均在同一平面上 | |
| C. | 与乙酰水杨酸具有相同官能团,且苯环上只有两个取代基的芳香族同分异构体共有8种(不考虑立体异构) | |
| D. | 服用阿司匹林药量过大时,可出现精神错乱、惊厥甚至昏迷等水杨酸反应,可用小苏打溶液解毒 |
18.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1mol甲醇中含有的共价键数为4 NA | |
| B. | 5.6g乙烯和环丁烷(C4H8)的混合气体中含的碳原子数为0.4 NA | |
| C. | 常温下,pH=2的盐酸溶液中含有的H+数目为0.02NA | |
| D. | 常温下,1L 0.5 mol/L的FeCl3溶液中,所含Fe3+数为0.5NA |
15.下列关于有机化合物的认识正确的是( )
①在铁粉存在下,苯与液溴的反应属于取代反应
②氯乙烷与NaOH水溶液共热可生成乙烯
③甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同
④苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
⑤用酸性高锰酸钾溶液可区分己烷和3-己烯
⑥用水可区分苯和溴苯.
①在铁粉存在下,苯与液溴的反应属于取代反应
②氯乙烷与NaOH水溶液共热可生成乙烯
③甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同
④苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
⑤用酸性高锰酸钾溶液可区分己烷和3-己烯
⑥用水可区分苯和溴苯.
| A. | ①②④⑤⑥ | B. | ①②③④⑤ | C. | ①③④⑤⑥ | D. | ②③④⑤⑥ |
1.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:
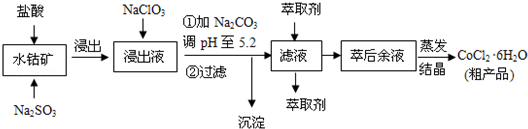
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110-120℃时,失去结晶生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+,防止Co2+转化为Co(OH)2沉淀.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+,防止Co2+转化为Co(OH)2沉淀.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
2.下列化学用语表达正确的是( )
| A. | 氮气的电子式  | B. | 乙烯的结构简式 CH2CH2 | ||
| C. | CO2的结构式 O=O=C | D. | 苯分子的比例模型 |
 亚硝酸钠是重要的防腐剂.亚硝酸钠外观与食盐非常相似,毒性较强,所以必须加以区分.以下是常用的两种鉴别NaCl和NaNO2 的方法:
亚硝酸钠是重要的防腐剂.亚硝酸钠外观与食盐非常相似,毒性较强,所以必须加以区分.以下是常用的两种鉴别NaCl和NaNO2 的方法: