题目内容
3.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )| 选项 | 实验 | 现象 | 结论 |
| A | 将滴有酚酞的0.1mol•L-1氨水系稀释成0.01mol•L-1 | 溶液颜色变浅 | 稀释后NH3•H2O的电离程度减小 |
| B | 将铜粉加入1.0mol•L-1Fe2(SO4)3溶液中 | 溶液变蓝、有黑色固体出现 | 金属铁比铜活泼 |
| C | 用溴乙烷与NaOH乙醇溶液共热产生的气体通入酸性KMnO4溶液中 | 溶液褪色 | 产生的气体为乙烯 |
| D | 向1mL0.1mol•L-1 MgSO4溶液滴入2滴等浓度的NaOH溶液,片刻后再滴加2滴0.1mol•L-1 CuSO4溶液 | 先有白色沉淀生成,后变为蓝色沉淀 | Cu(OH)2的溶度积常数比Mg(OH)2的小 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.稀释促进弱电解质的电离,但电离出离子浓度减小;
B.Cu与Fe2(SO4)3反应生成FeSO4、CuSO4;
C.溴乙烷与NaOH乙醇溶液共热,发生消去反应生成乙烯,但乙醇易挥发,乙烯、乙醇均能被高锰酸钾氧化;
D.由现象可知发生沉淀的转化.
解答 解:A.稀释促进弱电解质的电离,但电离出离子浓度减小,溶液颜色变浅,NH3•H2O的电离程度增大,故A错误;
B.Cu与Fe2(SO4)3反应生成FeSO4、CuSO4,则不能有黑色固体出现,与结论无关,故B错误;
C.溴乙烷与NaOH乙醇溶液共热,发生消去反应生成乙烯,但乙醇易挥发,乙烯、乙醇均能被高锰酸钾氧化,则溶液褪色不能说明有乙烯生成,故C错误;
D.由现象可知发生沉淀的转化,则Cu(OH)2的溶度积常数比Mg(OH)2的小,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握弱电解质的电离、沉淀转化、有机物的性质、氧化还原反应为解答的关键,侧重分析与实验能力的考查,注意反应原理与实验的结合,题目难度不大.

练习册系列答案
相关题目
13.以锌锰废电池中的碳包为原料回收MnO2的过程中涉及如下反应:
①MnO2(s)+C(s)═MnO(s)+CO(g)△H1=+24.4kJ•mol-1
②MnO2(s)+CO(g)═MnO(s)+CO2(g)△H2=-148.1kJ•mol-1
③2MnO2(s)+C(s)═2MnO(s)+CO2(g)△H3
则下列判断正确的是( )
①MnO2(s)+C(s)═MnO(s)+CO(g)△H1=+24.4kJ•mol-1
②MnO2(s)+CO(g)═MnO(s)+CO2(g)△H2=-148.1kJ•mol-1
③2MnO2(s)+C(s)═2MnO(s)+CO2(g)△H3
则下列判断正确的是( )
| A. | 碱性锌锰干电池属于二次电池 | B. | △H3=△H1+△H2 | ||
| C. | 反应①的活化能为24.4 kJ•mol-1 | D. | △H1<△H3 |
14.表中对离子方程式的正误判断及改正方法均正确的是( )
| 选项 | 化学反应 | 离子方程式 | 判断及改正方法 |
| A | CaCO3和醋酸溶液反应 | CaCO3+2H+═Ca2++H2O+CO2↑ | 正确 |
| B | 向Ba(OH)2溶液中加H2SO4溶液 | Ba2++OH-+H++SO42-═BaSO4↓+H2O | 错误:OH-、H+、H2O的化学计量数应均为2 |
| C | 过量的浓氨水加入到AlCl3溶液中 | Al3++3NH3•H2O═3NH4++Al(OH)3↓ | 错误:应生成AlO2-、NH4+、H2O |
| D | 将铜片插入硝酸银溶液中 | Cu+Ag+═Cu2++Ag | 正确 |
| A. | A | B. | B | C. | C | D. | D |
18.化学与生活、生产、环境密切相关. 下列说法不正确的是( )
| A. | 工厂排放 CO2会导致酸雨的形成 | |
| B. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 | |
| C. | “山东疫苗案”涉及疫苗未冷藏储运而失效,这与蛋白质变性有关 | |
| D. | 《黄白第十六》中有“曾青涂铁,铁赤如铜”,这与化学变化有关 |
15. 碳和碳的化合物在生产、生活中的应用非常广泛. 现将不同量的CO2(g)和H2(g)分别通入体积为2L的恒容密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),得到如下三组数据:
碳和碳的化合物在生产、生活中的应用非常广泛. 现将不同量的CO2(g)和H2(g)分别通入体积为2L的恒容密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),得到如下三组数据:
(1)实验1中,平衡常数K=0.9;v(H2)=0.15mol/(L•min)该反应的正反应为吸(填“吸”或“放”)热反应;
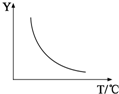
(2)实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强
(答一种情况即可);若该反应符合图所示的关系,则在图中Y轴表示CO2或H2的百分含量(或其浓度、质量、物质的量等合理答案即可).
(3)能判断该反应达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中c(CO ) 不变
c.v(H2)正=v(H2O)逆 d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O)由此可以判断此时的温度为830℃.其它条件不变,升高温度,原化学平衡向正反应方向移动(填“正”或“逆”),容器内混合气体的密度不变(填“增大”、“减小”或“不变”).
(5)若在该条件下,将0.4mol CO与0.2mol H2O(g)混合加热到830℃下达到平衡.平衡时CO的转化率33.3%.
 碳和碳的化合物在生产、生活中的应用非常广泛. 现将不同量的CO2(g)和H2(g)分别通入体积为2L的恒容密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),得到如下三组数据:
碳和碳的化合物在生产、生活中的应用非常广泛. 现将不同量的CO2(g)和H2(g)分别通入体积为2L的恒容密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| CO2 | H2 | CO | |||
| 1 | 800 | 4 | 2.5 | 1.5 | 5 |
| 2 | 830 | 2 | 2 | 1 | 3 |
| 3 | 830 | 2 | 2 | 1 | 1 |
(2)实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强
(答一种情况即可);若该反应符合图所示的关系,则在图中Y轴表示CO2或H2的百分含量(或其浓度、质量、物质的量等合理答案即可).
(3)能判断该反应达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中c(CO ) 不变
c.v(H2)正=v(H2O)逆 d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O)由此可以判断此时的温度为830℃.其它条件不变,升高温度,原化学平衡向正反应方向移动(填“正”或“逆”),容器内混合气体的密度不变(填“增大”、“减小”或“不变”).
(5)若在该条件下,将0.4mol CO与0.2mol H2O(g)混合加热到830℃下达到平衡.平衡时CO的转化率33.3%.

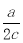 L C.ac L D.2ac L
L C.ac L D.2ac L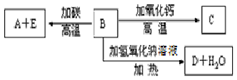 A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示.A为地壳中含量仅次于氧的非金属元素的单质.
A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示.A为地壳中含量仅次于氧的非金属元素的单质.