题目内容
16.在标准状况下,a g气体X与b g气体Y的分子数相同,下列说法正确的是( )| A. | 标准状况下,等质量的X和Y体积之比为a:b | |
| B. | 同温同压下,气体X和气体Y密度之比为b:a | |
| C. | 同物质的量的气体X和气体Y的质量之比为b:a | |
| D. | 25℃时,1 g气体X和1 g气体Y的分子数之比为b:a |
分析 ag气体X与b g气体y的分子数相同,根据N=nNA可知,二者物质的量相等,根据M=$\frac{m}{n}$可知x与y的摩尔质量之比为a:b,
A.等质量两种气体的物质的量之比为b:a,同温同压下体积之比等于物质的量之比;
B.相同条件下,密度之比等于摩尔质量之比;
C.等物质的量的两种气体的质量之比等于摩尔质量之比;
D.等质量两种气体的物质的量之比为b:a,物质的量之比等于分子数之比.
解答 解:相同条件下,ag气体X与bg气体Y的分子数相同,二者的物质的量相同,故二者摩尔质量之比为a:b,
A、等质量两种气体的物质的量之比为b:a,同温同压下体积之比等于物质的量之比,所以等质量的X和Y体积之比为b:a,故A错误;
B.相同条件下,密度之比等于摩尔质量之比,故同温同压下,气体X和气体Y的密度比是a:b,故B错误;
C.等物质的量的两种气体的质量之比等于摩尔质量之比,所以同物质的量的气体X和气体Y的质量之比为a:b,故C错误;
D.等质量两种气体的物质的量之比为b:a,物质的量之比等于分子数之比为:b:a,故D正确;
故选:D.
点评 本题考查阿伏伽德罗定律及推论、常用化学计量的有关计算,比较基础,可借助PV=nRT理解阿伏伽德罗定律及推论.

练习册系列答案
相关题目
2.下列关于有机物的说法正确的是( )
| A. | 糖类、油脂和蛋白质都是人体必需的营养物质,都属于高分子化合物 | |
| B. | 乙醇、乙酸均能与NaOH反应.是因为分子中均含有官能团“-OH” | |
| C. | 分子式为C6H12且碳碳双键在链端的烯烃共有6种异构体 | |
| D. | 分子式为C4H7ClO2的羧酸可能有5种 |
11.常温下,下列各组离子在指定溶液中可能大量共存的是( )
| A. | 0.l mol•L-1的NaAlO2溶液:K+、Na+、SO42-、HCO3- | |
| B. | 在pH=1的溶液中:NH4+、Fe3+、SO42-、Cl- | |
| C. | 含有大量ClO-溶液中:K+、OH-、I-、SO32- | |
| D. | c(Cu2+)=0.1 mol•L-1的溶液中:Na+、Cl-、AlO2-、HS- |
1.列说法中,正确的是( )
| A. | 冰融化时,分子中H-O键发生断裂 | |
| B. | 原子晶体中,共价键越强,熔点越高 | |
| C. | 分子体中,共价键键能越大,该分子晶体的熔、沸点一定越高 | |
| D. | 分子晶体中,分子间作用力越大,该物质越稳定 |
8.下列离子方程式书写正确的是( )
| A. | NaAlO2溶液中通入过量CO2气体:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| B. | NH4 HCO3溶液与足量的NaOH溶液反应:HCO3-+OH-═CO32-+H2O | |
| C. | 向Al2(SO4)3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | 向FeI2溶液中通入少量Cl2:2Fe2++Cl2═2Fe3++2Cl- |
5.高铁酸钠(Na2FeO4)是一种新型净水剂,制取Na2FeO4的离子方程式为:Fe3++OH-+Cl2→FeO42-+Cl-+H2O,该反应配平的离子方程式中H2O的系数是( )
| A. | 4 | B. | 6 | C. | 8 | D. | 10 |
6.下列有关化学用语表示正确的是( )
| A. | 原子核内有10个中子的氧原子:818O | |
| B. | HF的电子式:H+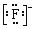 | |
| C. | Cl-离子的结构示意图: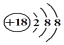 | |
| D. | N2的结构式::N≡N: |