题目内容
在标准状况下,将SO2 和Cl2气体混合,测得混合气体相对HCl的密度是1.85.将该混合气体2.24L溶于100mL水中制成溶液,已知该溶液的密度为1.05g/cm3.(已知:SO2+Cl2+H2O═H2SO4+2HCl),计算该混合溶液中H+的物质的量浓度.(计算最终结果保留两位小数,书写计算过程)
考点:化学方程式的有关计算
专题:计算题
分析:设混合气体中SO2 为xmol,Cl2为ymol,则x+y=
=0.1mol,
测得混合气体相对HCl的密度是1.85,则混合气体的相对分子质量为HCl的1.85倍,即混合气体的相对分子质量为1.85×36.5=67.525,
则
=67.5,
求出SO2 和Cl2的物质的量,再根据方程式求出酸的物质的量和氢离子的浓度.
| 2.24L |
| 22.4L/mol |
测得混合气体相对HCl的密度是1.85,则混合气体的相对分子质量为HCl的1.85倍,即混合气体的相对分子质量为1.85×36.5=67.525,
则
| 64x+71y |
| x+y |
求出SO2 和Cl2的物质的量,再根据方程式求出酸的物质的量和氢离子的浓度.
解答:
解:设混合气体中SO2 为xmol,Cl2为ymol,则x+y=
=0.1mol,
测得混合气体相对HCl的密度是1.85,则混合气体的相对分子质量为HCl的1.85倍,即混合气体的相对分子质量为1.85×36.5=67.525,
则
=67.5,
解得:x=0.05mol,y=0.05mol,
已知:SO2+Cl2+H2O═H2SO4+2HCl
则SO2 和Cl2恰好反应生成0.05molH2SO4和0.1molHCl,则溶液中n(H+)=0.2mol,
溶液的体积V=
=
=101.7mL=0.1017L,
则c(H+)=
=1.97mol/L;
答:该混合溶液中H+的物质的量浓度1.97mol/L.
| 2.24L |
| 22.4L/mol |
测得混合气体相对HCl的密度是1.85,则混合气体的相对分子质量为HCl的1.85倍,即混合气体的相对分子质量为1.85×36.5=67.525,
则
| 64x+71y |
| x+y |
解得:x=0.05mol,y=0.05mol,
已知:SO2+Cl2+H2O═H2SO4+2HCl
则SO2 和Cl2恰好反应生成0.05molH2SO4和0.1molHCl,则溶液中n(H+)=0.2mol,
溶液的体积V=
| m |
| ρ |
| 64g/mol×0.05mol+71g/mol×0.05mol+100g |
| 1.05g/cm3 |
则c(H+)=
| 0.2mol |
| 0.1017L |
答:该混合溶液中H+的物质的量浓度1.97mol/L.
点评:本题考查的混合物的计算,涉及物质的量和物质的量浓度的有关计算,题目难度中等,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
a molN2和amolNO相比较,下列叙述中正确的是( )
| A、所含质量相等 |
| B、所含原子数总数相等 |
| C、所含电子数相等 |
| D、所含氮原子数相等 |
甲烷在足量氧气中燃烧生成二氧化碳和水,由该实验事实可以得出的结论是( )
| A、甲烷的分子式为CH4 |
| B、甲烷中含有碳元素和氢元素 |
| C、甲烷中只含碳元素和氢元素 |
| D、甲烷的化学性质比较稳定 |
下列叙述中,能证明某物质是弱电解质的是( )
| A、熔化时不导电 |
| B、易溶于水 |
| C、水溶液的导电能力很差 |
| D、溶液中已电离的离子和未电离的分子共存 |
下列说法正确的是( )
| A、用等体积的蒸馏水或0.01mol/L盐酸洗涤AgCl沉淀,AgCl的损失量相同 |
| B、向氨水中加入NH4Cl 或Na2CO3 固体,溶液的pH均增大,水的电离程度均增大 |
| C、稀醋酸加入少量NaOH,恢复至室温后溶液的H+浓度减少,醋酸电离平衡常数不变 |
| D、NaClO与Na2CO3等物质的量混合的溶液中:c(Na+ )+c(H+)=c(OH-)+c(ClO-)+c(HCO3 -)+2c(CO32-) |
下列有关仪器使用方法或实验操作正确的是( )
| A、洗净的锥形瓶和容量瓶可以放进烘箱中烘干 |
| B、用激光笔检验KI溶液中是否溶有淀粉 |
| C、配制硫酸亚铁溶液时,应将绿矾晶体溶于蒸馏水再加入一定量的铁粉 |
| D、用分液漏斗分离乙酸乙酯和饱和碳酸钠溶液时,应打开活塞,使乙酸乙酯缓慢流出 |
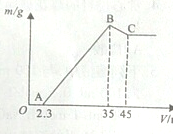 准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol?L-1的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示.请回答下列问题:
准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol?L-1的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示.请回答下列问题: