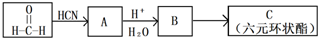
题目内容
在反应:3BrF3+5H2O=HBrO3+Br2+9HF+O2中
(1)当有5mol水参加反应时,由H2O还原的BrF3为 mol;由BrF3还原的BrF3为 mol;总的被还原的BrF3为 mol.
(2)当有5mol水作还原剂参加化学反应时,由水还原的BrF3为 mol;由BrF3还原的BrF3为 mol;总的被还原的BrF3为 mol.
(3)当有5mol水未参加氧化还原反应时,由水还原的BrF3为 mol;由BrF3还原的BrF3为
mol;总的被还原的BrF3为 mol.
(1)当有5mol水参加反应时,由H2O还原的BrF3为
(2)当有5mol水作还原剂参加化学反应时,由水还原的BrF3为
(3)当有5mol水未参加氧化还原反应时,由水还原的BrF3为
mol;总的被还原的BrF3为
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:3BrF3+5H2O═HBrO3+Br2+9HF+O2中,Br元素的化合价分别由+3价升高为+5价、由+3价降低为0,O元素的化合价由-2价升高为0,该反应中转移6e-,以此计算解答.
解答:
解:(1)当有5mol水参加反应时,O元素化合价由-2价升高到0价,2mol水被氧化,失去4mol电子,Br元素化合价由+3价降低到0价,则由H2O还原的BrF3为
=
mol,Br元素的化合价由+3价升高为+5价,转移2mol电子,被其本身还原的BrF3的物质的量为
mol=
mol,总的被还原的BrF3为2mol,
故答案为:
;
;2;
(2)当有5mol水作还原剂参加化学反应时,失电子10mol,生成2.5molO2,则7.5mol BrF3参加反应,生成2.5molHBrO3,由水还原的BrF3为
=
mol,由BrF3还原的BrF3为
=
mol,总的被还原的BrF3为5mol,
故答案为:
;
;2;
(3)当有5mol水参加反应时有2mol被氧化生成氧气,3mol未被氧化,则当有5mol水未参加氧化还原反应时,有
mol水被氧化,生成
mol氧气,
生成
molHBrO3,由水还原的BrF3为
mol=
mol,由BrF3还原的BrF3为
mol=
mol,总的被还原的BrF3为
mol+
mol=
mol,
故答案为:
;
;
.
| 4mol |
| 3-0 |
| 4 |
| 3 |
| 2mol |
| 3-0 |
| 2 |
| 3 |
故答案为:
| 4 |
| 3 |
| 2 |
| 3 |
(2)当有5mol水作还原剂参加化学反应时,失电子10mol,生成2.5molO2,则7.5mol BrF3参加反应,生成2.5molHBrO3,由水还原的BrF3为
| 10mol |
| 3-0 |
| 10 |
| 3 |
| 2.5mol×2 |
| 3 |
| 5 |
| 3 |
故答案为:
| 10 |
| 3 |
| 5 |
| 3 |
(3)当有5mol水参加反应时有2mol被氧化生成氧气,3mol未被氧化,则当有5mol水未参加氧化还原反应时,有
| 10 |
| 3 |
| 5 |
| 3 |
生成
| 5 |
| 3 |
| ||
| 3-0 |
| 20 |
| 9 |
| ||
| 3 |
| 10 |
| 9 |
| 20 |
| 9 |
| 10 |
| 9 |
| 10 |
| 3 |
故答案为:
| 20 |
| 9 |
| 10 |
| 9 |
| 10 |
| 3 |
点评:本题考查氧化还原反应计算,为高频考点,把握反应中元素的化合价变化为解答的关键,注意从元素化合价角度分析,侧重电子守恒的考查,题目难度较大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
粗略测定草木灰中碳酸钾的含量并检验钾元素的存在,图示中涉及的对应操作不规范的是( )
A、 称量 |
B、 溶解 |
C、 蒸发 |
D、 焰色反应 |
 ,回答下列问题:
,回答下列问题: