题目内容
19.氢化钠(NaH)是一种白色的离子化合物,其中钠元素为+1价,NaH与水反应生成氢气.下列叙述正确的是( )| A. | NaH在水中显酸性 | |
| B. | NaH中氢离子电子排布与氦原子相同 | |
| C. | NaH中氢离子半径比锂离子的大 | |
| D. | NaH中氢离子可以被还原成氢气 |
分析 A、氢化钠和水反应生成氢气,根据原子守恒判断另一种物质,由生成物的酸碱性判断;
B、先判断氢离子的电子数,再把其电子层排布与氦原子的比较判断;
C、根据电子层结构相同的离子半径与核电荷数的关系判断;
D、根据氢化钠和水反应时化合价的变化判断;
解答 解:A、氢化钠和水反应生成氢气和氢氧化钠NaH+H2O=H2+NaOH,生成物中有氢氧化钠,所以显碱性,故A错误.
B、NaH中H元素是-1价,其核外电子数为2,所以其电子层排布与氦原子的相同,故B正确.
C、负一价氢离子和锂离子的电子层结构相同,电子层结构相同的离子半径与核电荷数成反比,所以氢离子半径大于锂离子半径,故C正确.
D、NaH+H2O=H2+NaOH,氢化钠氢离子失电子被氧化生成氢气,故D错误.
故选BC.
点评 本题考查了粒子半径比较及元素化合物的知识,题目难度不大,注意利用盐类水解理解NaH与水的反应.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
10. 科学家最近开发了一种“叶片绿色电池”,利用CO2和H2O合成甲醇,示意图如下,关于该电池的说法正确的是( )
科学家最近开发了一种“叶片绿色电池”,利用CO2和H2O合成甲醇,示意图如下,关于该电池的说法正确的是( )
 科学家最近开发了一种“叶片绿色电池”,利用CO2和H2O合成甲醇,示意图如下,关于该电池的说法正确的是( )
科学家最近开发了一种“叶片绿色电池”,利用CO2和H2O合成甲醇,示意图如下,关于该电池的说法正确的是( )| A. | 该新型电池仅存在化学能与电能的转化 | |
| B. | 电池总反应为2CO2+4H2O=2CH3OH+3O2 | |
| C. | 电子从电极b流向电极a | |
| D. | 产生标准状况下2.24 LO2,转移电子0.6NA |
10.由于具有超低耗电量、寿命长的特点,LED产品越来越受人欢迎,下图是氢氧燃料电池驱动LED发光的装置.下列有关叙述正确的是( )
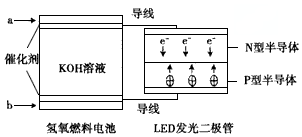

| A. | 电池负极电极反应式为H2-2e-+2OH-=2H2O | |
| B. | a处通入氧气,b处通入氢气 | |
| C. | 该装置中能量转化只涉及两种形式的能量 | |
| D. | P一型半导体连接的是电池负极 |
7.下列 反应中不属于氧化还原反应的是( )
| A. | 铝热反应 | B. | 灼烧氢氧化铝固体 | ||
| C. | 氯水使湿润的淀粉碘化钾试纸变蓝 | D. | 电解饱和食盐水制取氯气 |
14.下列物质中,既能跟盐酸反应,又能跟氢氧化钠溶液反应的是( )
| A. | NaAlO2 | B. | Al2O3 | C. | Fe2O3 | D. | AlCl3 |
4.下列反应进行分类时,既属于氧化还原反应又属于分解的是( )
| A. | Fe+H2SO4=FeSO4+H2↑ | B. | CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ | ||
| C. | CO2+C$\frac{\underline{\;\;△\;\;}}{\;}$2CO | D. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ |
11.用下列有关实验装置进行相应实验,能达到实验目的是( )
| A. |  如图:配制0.10 mol•L-1NaOH的溶液 | |
| B. |  如图:除氯气中的氯化氢气体 | |
| C. |  如图:制备氢氧化铁胶体 | |
| D. |  如图:用装置④陶瓷坩埚高温煅烧CaCO3固体 |
8.下列关于硅及其化合物的叙述正确的是( )
| A. | 硅晶体可用于制造光导纤维 | |
| B. | 陶瓷、玻璃、水泥都是硅酸盐产品 | |
| C. | 二氧化硅在电子工业中是重要的半导体材料 | |
| D. | 二氧化硅与氢氟酸和氢氧化钠均能反应,属于两性氧化物 |
8.下列分子中,最难分裂成原子的是( )
| A. | HF | B. | HCl | C. | HBr | D. | HI |