��Ŀ����
14������ˮ����������ɵĵ���Ⱦ�ѳ�Ϊһ�������ԵĻ������⣬ij����������Fe�ۺ�����KNO3��Һ��Ӧģ�����ˮ�ѵ����̣�������ѵ�ԭ��Ϊ��4Fe+NO3-+10H+=4Fe2++NH4++3H2O����1���о����֣�����KNO3��Һ���Եļ�������Ӧ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�ͣ�����������������KNO3��Һ����ʵ�飬û�й۲쵽�������ɣ����������KNO3�Ļ�ԭ���������NH4+����ѧʽ����
��2��ʵ�鷢�֣���Ӧһ��ʱ���Ӧ��ϵ��NH4+��Ũ��������Fe2+��Ũ��ȴû�������ܵ�ԭ����ab��
a�����ɵ�Fe2+ˮ�� b��Fe2+����������Fe3+ c��Fe2+����ԭ��Fe
��3���ÿ����������������ѵ���Ӧ�о���ͬ�Ա����Է�Ӧ���ʵ�Ӱ�죮
�����õ����Լ����������ֿ���Fe�ۡ�ϸ����Fe�ۡ�2.0mol/L KNO3��0.1mol/L H2SO4������ˮ����ͬ�¶ȵĺ���ˮԡ��������ƽ�����������ɫ���ǵȣ�
�����ʵ�鷽�����ڲ�ͬ���Ա������¶ȡ����ۿ����Ĵ�С��ʱ���ⶨ��ͬ���������������Ũ�ȵı仯����Ҫ������õ�������ֱ�����ַ�Ӧ���ʴ�С����
�ڲ����±���ʽ���ⶨʵ�������������ʵ�鷽�����г���ѡ�Լ���������¼�Ĵ��������������ⶨ�����ݣ���������ĸ��ʾ����
����ʾ������ɫ�����ܸ��ٲⶨ��Һ�е�c��NO3-��
| ������ ʵ����� | V��2.0mol/L KNO3��/ mL | �� | |
| 1 | a | �� | |
| 2 | a | �� | |
| 3 | a | �� |
���� ��1������KNO3��Һ���Եļ�������Ӧ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�ͣ���û�й۲쵽�������ɣ�˵��������Σ�
��2�����Fe2+�����ʣ�������ԭ��Ӧ�������������ӵ�Ũ�Ȳ���˵���������ӷ�����Ӧ�������������������ӿ�����ˮ������٣��������Ӿ��л�ԭ�ԣ���������������Ӧ�����٣����������
��3���ٿ���ͨ����λʱ������������ӵ�Ũ�ȱ仯�����߸���������ͬ������������������ʱ�䣬�����ַ�Ӧ���ʿ�����
�ڲⶨ��ͬʱ����ͬ���ͬŨ�ȵ����������������ͬ�����Ĵ����۷�Ӧ���������Ũ�ȵı仯���Է�Ӧ���ʵ�Ӱ�죬����ͬ���ͬŨ�ȵ����������������ͬ�����Ĵ����۷�Ӧ������ͬŨ�ȵ�������������ⶨ��Ӧ�����ʱ�䣻
�۹���ԭ��ؼӿ컯ѧ��Ӧ���ٶȣ��ɴ˷������
��� �⣺��1������KNO3��Һ���Եļ�������Ӧ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�ͣ���û�й۲쵽�������ɣ�˵��������Σ����Ը�������KNO3�Ļ�ԭ�����������Σ��ʴ�Ϊ��NH4+��
��2��a�����ɵ�Fe2+ˮ�⣬����Fe2+��Ũ��ȴû��������ȷ��
b��Fe2+����������Fe3+������Fe2+��Ũ��ȴû��������ȷ��
c����������Fe2+����Ӧ���ʴ���
��ѡ��ab��
��3���ٿ���ͨ����λʱ������������ӵ�Ũ�ȱ仯�����߸���������ͬ������������������ʱ�䣬�����ַ�Ӧ���ʿ������ʴ�Ϊ��ͨ����λʱ������������ӵ�Ũ�ȱ仯����
�ڲⶨ��ͬʱ����ͬ���ͬŨ�ȵ����������������ͬ�����Ĵ����۷�Ӧ���������Ũ�ȵı仯���Է�Ӧ���ʵ�Ӱ�죬����ͬ���ͬŨ�ȵ����������������ͬ�����Ĵ����۷�Ӧ������ͬŨ�ȵ�������������ⶨ��Ӧ�����ʱ�䣬�ʴ�Ϊ��
| ������ ʵ����� | V��2.0mol/L KNO3��/mL | V��0.1mol/L H2SO4��/mL | T��ˮԡ�¶ȣ�/�� | m���ֿ������ۣ�/g | m��ϸ�������ۣ�/g | ���������Ũ�ȵı仯�� | t����Ӧʱ�䣩 |
| �� | a | b | T1 | c | 0 | t | |
| �� | a | b | T2 | c | 0 | t | |
| �� | a | b | T1 | 0 | c | t |
�ۻ���̿����������������С��ԭ��أ�����ԭ��ؼӿ컯ѧ��Ӧ���ٶȣ��ʴ�Ϊ������̿����������������С��ԭ��أ�
���� ���⿼��Ԫ�ػ���������ʡ���ѧ��Ӧ���ʡ��͵绯ѧ�����⣬�ۺ��Խ�ǿ�����ʵ�鲽�裬ע�����Ե������Ժ������ԣ�

 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д�| A�� | ��һ�������ԭ���У��������������˶�״̬��ȫ��ͬ�ĵ��� | |
| B�� | ��һ�������ԭ���У�������������������ͬ�ĵ��� | |
| C�� | ��һ�������ԭ���У�N���ϵĵ��������϶���M���ϵĵ��������� | |
| D�� | ij�������ԭ�ӵ�3p�ܼ��Ͻ����������ӣ����ǵ�����״̬��Ȼ�෴ |
��1���ϳɰ���ԭ����N2��H2ͨ�����Խ�̿��ˮ�Ϳ���Ϊԭ������ȡ�ģ�����Ҫ��Ӧ�ǣ���2C+O2��2CO ��C+H2O��g����CO+H2 ��CO+H2O��g����CO2+H2
ij�������н���̿��H2O��g���Ϳ������������N2��O2�������Ϊ4��1����ͬ����Ϸ�Ӧ������������ᆳ������������±�������x=44m3��ʵ��������30 kg��̿��
| ���� | CO | N2 | CO2 | H2 | O2 |
| �����m3������״���� | x | 20 | 12 | 60 | 1.0 |
��1mol��������0.8molN2��0.2molO2��1300��ʱ���ܱ������ڷ�Ӧ�ﵽƽ�⣮���NOΪ8��10-4mol��������¶��µ�ƽ�ⳣ��K=$\frac{[NO]^{2}}{[{N}_{2}]•[{O}_{2}]}$=4��10-6��д������ʽ�������������������������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ��ԭ�����¶����ߣ���Ӧ���ʼӿ죬ƽ�����ƣ�
��3��SO2�͵��������ﶼ�ǿ����е��к����壬��֪��
2SO2��g��+O2��g��?2SO3��g����H=-196.6kJ•mol-1
2NO��g��+O2��g��?2NO2��g����H=-113.0kJ•mol-1
��ӦNO2��g��+SO2��g��?SO3��g��+NO��g���ġ�H=-41.8kJ•mol-1��
��4��25��ʱ������ƽ�ⳣ����
| ��ѧʽ | H2CO3 | HClO | H2C4H4O6����ʯ�ᣩ |
| ����ƽ�ⳣ�� | K1=4.3��10-7 K2=5.6��10-11 | 3.0��10-8 | K1=9.1��10-4 K2=4.3��10-5 |
a�������£���0.1mol/L�Ĵ�������Һ��0.1mol/L��̼������Һ�������ϣ�������Һ�и�������Ũ�ȹ�ϵ��ȷ����BCE
A��c��Na+����c��ClO-����c��HCO3-����c��OH-��
B��c��Na+����c��HCO3-����c��ClO-����c��H+��
C��c��Na+���Tc��HClO��+c��ClO-��+c��HCO3-��+c��H2CO3��+c��CO32-��
D��c��Na+��+c��H+���Tc��ClO-��+c��HCO3-��+2c��CO32-��
E��c��HClO��+c��H+��+c��H2CO3���Tc��OH-��+c��CO32-��
b.0.1mol/L�ľ�ʯ����Һ��pH=13��NaOH��Һ�������ϣ�������Һ��pHΪ6����c��HC4H4O6-��+2c��C4H4O62-��=��0.05+10-6-10-8��mol/L�����г�����ʽ��
| A�� | �кͷ�Ӧ��Ӧ�ȵIJⶨʵ���У������β�����������ɻ���ͭ˿������ⶨ�������к���ֵƫ�� | |
| B�� | ��101kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2��g��+O2��g���T2H2O��l����H=-571.6KJ/mol | |
| C�� | ��0.5molN2��1.5molH2�����ܱ������г�ַ�Ӧ����NH3��g��������19.3kJ�����Ȼ�ѧ����ʽΪ��N2��g��+3H2��g��?2NH3��g����H=-38.6KJ/mol | |
| D�� | HCl��NaOH��Ӧ���к��ȡ�H=-57.3KJ/mol����H2SO4��Ca��OH��2��Ӧ�ķ�Ӧ�ȡ�H=-��2��57.3��KJ/mol |
| A�� | 11��16 | B�� | 6��8 | C�� | 12��17 | D�� | 20��9 |
�����뾶��r��K+����r��Al3+����r��S2-����r��Cl-��
���⻯����ȶ��ԣ�HF��HCl��H2S��PH3��SiH4
�ۻ�ԭ�ԣ�S2-��Cl-��Br-��I-
�������ԣ�Cl2��S��Se��Te
�����ԣ�H2SO4��H3PO4��H2CO3��HClO
�ǽ����ԣ�O��N��P��Si
�߽����ԣ�Be��Mg��Ca��K��
| A�� | �� | B�� | �٢� | C�� | �ڢۢܢݢޢ� | D�� | �٢ۢ� |
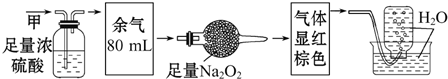
| A�� | NH3��NO2��N2 | B�� | NH3��NO��CO2 | C�� | NH3��NO2��CO2 | D�� | NO��CO2��N2 |