题目内容
19.碱金属元素原子最外层的电子都是1个,在化学反应它们容易失去1个电子;碱金属元素中金属性最强的是Cs,原子半径最小的是Li.卤族元素原子最外层的电子都是7个,在化学反应它们容易得到1个电子;在卤族元素中非金属性最强的是F,原子半径最小的是F.分析 碱金属移动原子最外层电子数都是1个,在化学反应中易失电子达到稳定结构,碱金属元素金属性随着原子序数增大而增强,原子半径随着原子序数增大而增大;
卤族元素原子最外层电子都是7个,在反应中易得电子达到8电子稳定结构,同一主族元素,元素的非金属性随着原子序数增大而减弱,原子半径随着原子序数增大而增大.
解答 解:碱金属移动原子最外层电子数都是1个,在化学反应中易失电子达到稳定结构,随着元素序数增大,原子核对最外层电子的吸引力逐渐减小,所以金属元素原子失电子能力增强,所以碱金属元素金属性随着原子序数增大而增强,电子层数越大,原子半径越大,所以碱金属元素原子半径随着原子序数增大而增大,碱金属性最强的是Cs、原子半径最小的是Li;
卤族元素原子最外层电子都是7个,在反应中易得1个电子达到8电子稳定结构,随着电子层数增大,原子核最最外层电子的吸引力减小,所以元素得电子能力降低,则卤族元素的非金属性随着原子序数增大而减弱,电子层数越大原子半径越大,所以原子半径随着原子序数增大而增大,所以非金属性最强的是F、原子半径最小的是F元素,
故答案为:1;1;Cs;Li;7;1;F;F.
点评 本题考查碱金属元素、卤族元素结构及其性质递变规律,结构决定性质,性质体现结构,知道碱金属、卤族元素性质递变原因,题目难度不大.

练习册系列答案
相关题目
10.共价键是有饱和性和方向性的,下列有关叙述不正确的是( )
| A. | 共价键的饱和性是由成键原子的未成对电子数决定的 | |
| B. | 共价键的方向性是由成键原子的轨道的方向性决定的 | |
| C. | 共价键的饱和性决定了分子内部的原子的数量关系 | |
| D. | 共价键的饱和性与原子轨道的重叠程度有关 |
14.地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题,某课题组利用Fe粉和酸性KNO3溶液反应模拟地下水脱氮过程,理想的脱氮原理为:4Fe+NO3-+10H+=4Fe2++NH4++3H2O.
(1)研究发现:随着KNO3溶液酸性的减弱,对应还原产物中氮元素的化合价越低.课题组用酸性弱的KNO3溶液进行实验,没有观察到气体生成,则该条件下KNO3的还原产物可能是NH4+(化学式).
(2)实验发现:反应一段时间后,反应体系中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是ab.
a.生成的Fe2+水解 b.Fe2+被氧化生成Fe3+ c.Fe2+被还原成Fe
(3)该课题组拟利用上述脱氮反应研究不同自变量对反应速率的影响.
可能用到的试剂和仪器:粗颗粒Fe粉、细颗粒Fe粉、2.0mol/L KNO3、0.1mol/L H2SO4、蒸馏水、不同温度的恒温水浴、托盘天平、秒表、离子色谱仪等.
①设计实验方案:在不同的自变量(温度、铁粉颗粒的大小)时,测定相同条件下硝酸根离子浓度的变化量(要求所测得的数据能直接体现反应速率大小).
②参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据:数据用字母表示).
【提示】离子色谱仪能跟踪测定溶液中的c(NO3-)
③进一步的研究表明:将铁粉和活性炭同时加入上述KNO3溶液中,可以明显提高脱氮速率,其原因是活性炭和铁构成了无数个微小的原电池.
(1)研究发现:随着KNO3溶液酸性的减弱,对应还原产物中氮元素的化合价越低.课题组用酸性弱的KNO3溶液进行实验,没有观察到气体生成,则该条件下KNO3的还原产物可能是NH4+(化学式).
(2)实验发现:反应一段时间后,反应体系中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是ab.
a.生成的Fe2+水解 b.Fe2+被氧化生成Fe3+ c.Fe2+被还原成Fe
(3)该课题组拟利用上述脱氮反应研究不同自变量对反应速率的影响.
可能用到的试剂和仪器:粗颗粒Fe粉、细颗粒Fe粉、2.0mol/L KNO3、0.1mol/L H2SO4、蒸馏水、不同温度的恒温水浴、托盘天平、秒表、离子色谱仪等.
①设计实验方案:在不同的自变量(温度、铁粉颗粒的大小)时,测定相同条件下硝酸根离子浓度的变化量(要求所测得的数据能直接体现反应速率大小).
②参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据:数据用字母表示).
【提示】离子色谱仪能跟踪测定溶液中的c(NO3-)
| 物理量 实验序号 | V(2.0mol/L KNO3)/ mL | … | |
| 1 | a | … | |
| 2 | a | … | |
| 3 | a | … |
4.某元素的原子序数为7,下列有关该元素的推断不正确的是( )
| A. | 它处在元素周期表中第二周期ⅤA族 | |
| B. | 它的最高正价为+5,负价为-3 | |
| C. | 它的最高价氧化物对应水化物是一种强酸 | |
| D. | 它的非金属性比磷弱比氧强 |
11.下列说法不正确的是( )
| A. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| B. | 用甘氨酸和丙氨酸缩合最多可形成4种二肽 | |
| C. | 分子式为C5H8O2,既能与Na2CO3溶液反应又能与溴的四氯化碳溶液反应的有机物有8种 | |
| D. | 乳酸薄荷醇酯( )能发生水解、氧化、消去反应 )能发生水解、氧化、消去反应 |
8.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 使石蕊呈红色的溶液:NH4+、Ba2+、ClO-、Cl- | |
| C. | 使酚酞呈红色的溶液:K+、Na+、CH3COO-、Br- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
9.实验室中某些气体的制取、除杂及收集装置如图所示.仅用此装置和表中提供的物质完成相关实验,最合理的是( )
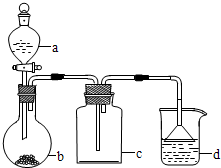

| 选项 | a种物质 | b种物质 | c种物质 | d中收集的气体 |
| A | 浓氨水 | NaOH | 浓硫酸 | NH3 |
| B | 稀盐酸 | CaCO3 | 浓硫酸 | CO2 |
| C | 稀硝酸 | Cu | 碱石灰 | NO |
| D | 浓盐酸 | KMnO4 | 水 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
