题目内容
4.无色的气体甲,可能含NO、O2、NH3、N2中的几种,将100mL甲气体经过如图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成可能为( )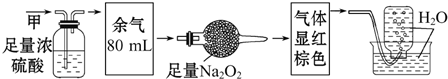
| A. | NH3、NO2、N2 | B. | NH3、NO、CO2 | C. | NH3、NO2、CO2 | D. | NO、CO2、N2 |
分析 二氧化氮是红棕色的气体,浓硫酸可以和氨气反应,二氧化碳可以和过氧化钠反应生成碳酸钠和氧气,一氧化氮无色,与氧气立即反应变为红棕色的二氧化氮,氮气不溶于水.
解答 解:二氧化氮是红棕色的气体,所以一定不存在NO2,甲气体经过足量的浓硫酸,剩余气体80毫升,说明一定有NH3存在,二氧化碳可以和过氧化钠反应生成碳酸钠和氧气,一氧化氮无色,与氧气立即反应变为红棕色的二氧化氮,通过足量的过氧化钠后气体显红棕色,说明有NO、CO2,
排水法收集气体,广口瓶被上升的水注满,说明没有N2,
所以混合气体的组成可能为:NH3、NO、CO2,
故选B.
点评 本题考查常见气体的检验和性质,是一道气体的鉴别题目,题目难度中等,注意氨气的碱性、二氧化碳和过氧化钠的反应原理,明确常见气体的性质及检验方法为解答关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题,某课题组利用Fe粉和酸性KNO3溶液反应模拟地下水脱氮过程,理想的脱氮原理为:4Fe+NO3-+10H+=4Fe2++NH4++3H2O.
(1)研究发现:随着KNO3溶液酸性的减弱,对应还原产物中氮元素的化合价越低.课题组用酸性弱的KNO3溶液进行实验,没有观察到气体生成,则该条件下KNO3的还原产物可能是NH4+(化学式).
(2)实验发现:反应一段时间后,反应体系中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是ab.
a.生成的Fe2+水解 b.Fe2+被氧化生成Fe3+ c.Fe2+被还原成Fe
(3)该课题组拟利用上述脱氮反应研究不同自变量对反应速率的影响.
可能用到的试剂和仪器:粗颗粒Fe粉、细颗粒Fe粉、2.0mol/L KNO3、0.1mol/L H2SO4、蒸馏水、不同温度的恒温水浴、托盘天平、秒表、离子色谱仪等.
①设计实验方案:在不同的自变量(温度、铁粉颗粒的大小)时,测定相同条件下硝酸根离子浓度的变化量(要求所测得的数据能直接体现反应速率大小).
②参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据:数据用字母表示).
【提示】离子色谱仪能跟踪测定溶液中的c(NO3-)
③进一步的研究表明:将铁粉和活性炭同时加入上述KNO3溶液中,可以明显提高脱氮速率,其原因是活性炭和铁构成了无数个微小的原电池.
(1)研究发现:随着KNO3溶液酸性的减弱,对应还原产物中氮元素的化合价越低.课题组用酸性弱的KNO3溶液进行实验,没有观察到气体生成,则该条件下KNO3的还原产物可能是NH4+(化学式).
(2)实验发现:反应一段时间后,反应体系中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是ab.
a.生成的Fe2+水解 b.Fe2+被氧化生成Fe3+ c.Fe2+被还原成Fe
(3)该课题组拟利用上述脱氮反应研究不同自变量对反应速率的影响.
可能用到的试剂和仪器:粗颗粒Fe粉、细颗粒Fe粉、2.0mol/L KNO3、0.1mol/L H2SO4、蒸馏水、不同温度的恒温水浴、托盘天平、秒表、离子色谱仪等.
①设计实验方案:在不同的自变量(温度、铁粉颗粒的大小)时,测定相同条件下硝酸根离子浓度的变化量(要求所测得的数据能直接体现反应速率大小).
②参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据:数据用字母表示).
【提示】离子色谱仪能跟踪测定溶液中的c(NO3-)
| 物理量 实验序号 | V(2.0mol/L KNO3)/ mL | … | |
| 1 | a | … | |
| 2 | a | … | |
| 3 | a | … |
19.下列方法中,不能用于实验室制取氨气的是( )
| A. | 将固体熟石灰和氯化铵混合加热 | |
| B. | 加热试管中的氯化铵固体 | |
| C. | 将烧瓶中的浓氨水加热 | |
| D. | 将分液漏斗中的浓氨水滴入装有碱石灰的烧瓶中 |
9.实验室中某些气体的制取、除杂及收集装置如图所示.仅用此装置和表中提供的物质完成相关实验,最合理的是( )
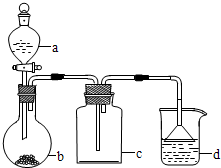

| 选项 | a种物质 | b种物质 | c种物质 | d中收集的气体 |
| A | 浓氨水 | NaOH | 浓硫酸 | NH3 |
| B | 稀盐酸 | CaCO3 | 浓硫酸 | CO2 |
| C | 稀硝酸 | Cu | 碱石灰 | NO |
| D | 浓盐酸 | KMnO4 | 水 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
13.反应N2+3H2?2NH3刚开始时只通入N2和H2且N2的浓度为3mol•L-1,H2的浓度为5mol•L-1,5min后测得NH3浓度为 1 mol•L-1,则此时间内,下列反应速率表示正确的是( )
| A. | v(NH3)=0.2 mol•L-1•s-1 | B. | v(N2)=0.2 mol•L-1•min-1 | ||
| C. | v(H2)=0.2 mol•L-1•min-1 | D. | v(H2)=0.3 mol•L-1•min-1 |
14.锌与100mL 18.5mol•L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6L(标准状况).将反应后的溶液稀释至1L,测得溶液的氢离子浓度为0.1mol/L,下列叙述不正确的是( )
| A. | 反应中共转移3 mol电子 | B. | 反应中共消耗1.8 mol H2SO4 | ||
| C. | 反应中共消耗97.5 g Zn | D. | 气体甲中SO2与H2的体积比为4:1 |
 .
.