题目内容
 在容积可变的密闭容器中,由CO和H2合成甲醇CO(g)+2H2(g)═CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图所示.
在容积可变的密闭容器中,由CO和H2合成甲醇CO(g)+2H2(g)═CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图所示.(1)该反应的平衡常数表达式为K=
(2)工业实际生产中,该反应条件控制在250℃、1.3×104kPa左右,选择此压强而不选择更高压强的理由是
(3)在图中画出350℃时CO的平衡转化率随压强变化的大致曲线.
考点:化学平衡的影响因素,化学平衡常数的含义
专题:化学平衡专题
分析:(1)根据K=
来书写K的表达式 温度对K的影响和反应的吸放热情况有关来回答;
(2)根据压强对化学反应速率以及化学平衡移动的影响知识结合实际生产过程来回答;
(3)反应是放热反应,升高温度,平衡逆向进行.
| 生成物浓度的幂次方乘积 |
| 反应物浓度的幂次方乘积 |
(2)根据压强对化学反应速率以及化学平衡移动的影响知识结合实际生产过程来回答;
(3)反应是放热反应,升高温度,平衡逆向进行.
解答:
解:(1)反应CO(g)+2H2(g)═CH3OH(g)的平衡常数K=
,根据CO在不同温度下的平衡转化率与压强的关系图2,可以知道该反应是一个放热反应,所以升高温度,平衡常数减小,压强大小和平衡常数之间无关,即250℃、0.5×104kPa下的平衡常数大于300℃、1.5×104kPa下的平衡常数,
故答案为:
;>;
(2)根据CO在不同温度下的平衡转化率与压强的关系图2,可以知道在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失,
故答案为:在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失;
③该反应是一个放热反应,所以升高温度,平衡常数减小,350℃时CO的平衡转化率小于恒压下300℃时CO的平衡转化率,即350℃时CO的平衡转化率随压强变化的大致曲线随压强变化的大致曲线为: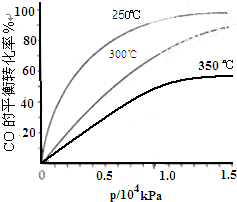 ,故答案为:
,故答案为: .
.
| [CH3OH] |
| [CO]?[H2]2 |
故答案为:
| [CH3OH] |
| [CO]?[H2]2 |
(2)根据CO在不同温度下的平衡转化率与压强的关系图2,可以知道在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失,
故答案为:在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失;
③该反应是一个放热反应,所以升高温度,平衡常数减小,350℃时CO的平衡转化率小于恒压下300℃时CO的平衡转化率,即350℃时CO的平衡转化率随压强变化的大致曲线随压强变化的大致曲线为:
 ,故答案为:
,故答案为: .
.
点评:本题目综合考查学生对化学平衡常数表达式、化学平衡状态的判断、以及化学平衡的计算知识,属于综合知识的考查,难度大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列有关物质的性质和该性质的应用叙述不正确的是( )
| A、所有酸中,二氧化硅只与氢氟酸反应,可用石英制造耐酸容器 |
| B、工业上金属Mg、Al都是用电解其熔融的氯化物制得的 |
| C、二氧化氯具有氧化性,可用于自来水的杀菌消毒 |
| D、若铁制品表面的钢镀层有破损,会加快铁制品腐蚀 |
 如图所示,在密闭容器中,一边装有一定量的金属钠,一边装有一定量的氧化汞,同时加热容器的两部分,钠和氧化汞都完全反应后,恢复到原温度,容器内空气的成分仍不变.则钠和氧化汞的物质的量之比是( )
如图所示,在密闭容器中,一边装有一定量的金属钠,一边装有一定量的氧化汞,同时加热容器的两部分,钠和氧化汞都完全反应后,恢复到原温度,容器内空气的成分仍不变.则钠和氧化汞的物质的量之比是( )| A、1:1 |
| B、2:1 |
| C、23:216.6 |
| D、216.6:23 |
相同质量的铁与足量的稀H2SO4及足量的CuO制单质铜,有人设计以下两种方案:①Fe
H2
Cu,②CuO
CuSO4
Cu.若实验过程中,根据一般的实验方法和实验操作规则进行操作,则两者制得单质铜的量作比较正确的是( )
| 稀硫酸 |
| 氧化铜 |
| 稀硫酸 |
| 铁 |
| A、相等 | B、①多 |
| C、②多 | D、无法判断 |
下列叙述正确的是( )
| A、Cl2和SO2的漂白原理不同,混合使用效果更好 |
| B、常温下,向饱和的Na2CO3溶液中通入大量的CO2气体,结果有晶体析出 |
| C、用铂丝蘸取某溶液在酒精灯火焰上灼烧,透过蓝色钻玻璃观察到火焰颜色为紫色,说明原溶液中不含Na+ |
| D、FeCl2和Fe(OH)3都不能通过化合反应直接制取 |
下列有关物质的性质和应用正确的是( )
| A、在电热水器的钢铁内胆中装入铜棒可以防止内胆被腐蚀 |
| B、二氧化硅具有半导体性能,可以制成光电池 |
| C、二氧化氯(ClO2)和臭氧可用作自来水消毒剂 |
| D、油脂水解可得到氨基酸和甘油 |
 实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有: