题目内容
15.硫的多种化合物在工业中有重要的应用.(1)连二亚硫酸钠(Na2S2O4)又称保险粉,是最适合木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性.
①Na2S2O4中S元素的化合价为+3.
②Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,发生反应时,当氧化剂和还原剂的物质的量之比为l:2时,产物为NaHSO3(填化学式).
③将甲酸和NaOH溶液混合,再通入SO2气体,会得到保险粉,此时甲酸被氧化为CO2.该反应的化学方程式为HCOOH+2SO2+2NaOH=Na2S2O4+CO2+H2O.
(2)铬会造成环境污染.某酸性废水中含有Cr2O72-,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,再调节pH至8,使铬元索沉降,分离出污泥后测得废水中Cr3+浓度为0.52mg/L,达到排放标准.
①Na2S2O5参加反应的离子方程式为3S2O52-+2Cr2O72-+10H+=6SO42-+4Cr3++5H2O.
②处理后的废水中Cr3+的物质的量浓度为1×10-5mol/L.
分析 (1)①根据化合价代数和为0分析;
②Na2S2O4暴露于空气中易被氧气氧化,则氧化剂为氧气,还原剂为Na2S2O4,根据得失电子守恒计算反应后产物;
③根据题意,甲酸和NaOH溶液混合,再通入SO2气体,甲酸被氧化为CO2,SO2气体被还原成Na2S2O4,据此书写方程式;
(2)①焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,同时焦亚硫酸钠被氧化为硫酸钠,根据电子守恒和原子守恒书写方程式;
②根据分离出污泥后测得废水中Cr3+浓度为0.52mg/L计算Cr3+的物质的量浓度.
解答 解:(1)①因为Na为+1价,O为-2价,根据化合价代数和为0,则S为+3价,故答案为:+3;
②Na2S2O4暴露于空气中易被氧气氧化,则氧化剂为氧气,还原剂为Na2S2O4,又氧化剂和还原剂的物质的量之比为l:2,设Na2S2O4被氧化后硫的化合价为+x价,则根据得失电子守恒,1×4=2×2×(x-3),解得x=4,又有水蒸气参与反应,所以产物为NaHSO3;故答案为:NaHSO3;
③根据题意,甲酸和NaOH溶液混合,再通入SO2气体,甲酸被氧化为CO2,SO2气体被还原成Na2S2O4,则方程式为HCOOH+2SO2+2NaOH=Na2S2O4+CO2+H2O;故答案为:HCOOH+2SO2+2NaOH=Na2S2O4+CO2+H2O;
(2)①焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,同时焦亚硫酸钠被氧化为硫酸钠,其反应的离子方程式为:3S2O52-+2Cr2O72-+10H+=6SO42-+4Cr3++5H2O;
故答案为:3S2O52-+2Cr2O72-+10H+=6SO42-+4Cr3++5H2O;
②分离出污泥后测得废水中Cr3+浓度为0.52mg/L,c(Cr3+)=$\frac{0.52×10{\;}^{-3}g/L}{52g/mol}$=1×10-5mol/L;
故答案为:1×10-5.
点评 本题考查了物质的性质及其氧化还原反应原理,题目难度中等,正确分析题中给予信息为解答关键,试题知识点较多,充分考查了学生的分析、理解能力.

 阅读快车系列答案
阅读快车系列答案| A. | FeO | B. | Fe2O3 | C. | Fe3O4 | D. | 无法确定 |
| A. | 12C与14C为不同核素 | |
| B. | 石墨和C60的互为同素异形体 | |
| C. | H2O和D2O互为同位素 | |
| D. | 氨基酸分子中均含有羧基(-COOH)和氨基(-NH2) |
| A. | 含大量OH-的溶液:Ba2+、K+、NO3-、AlO2- | |
| B. | 加人Na2O2粉末的溶液:Na+、Cl-、SO32-、OH- | |
| C. | c(KNO3)=1.0mol/L的溶液:H+、I-、Cl-、Ca2+ | |
| D. | 滴入紫色石蕊试液呈蓝色的溶液:Fe3+、Ba2+、HCO3-、Br- |
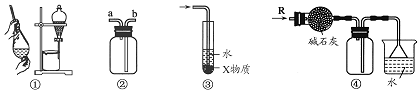
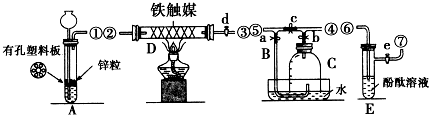
| A. | 装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 | |
| B. | 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 | |
| C. | 装置①可用于分离C2H5OH和H2O的混合物 | |
| D. | 装置④可用于干燥、收集NH3,并吸收多余的NH3 |
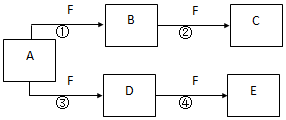 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,D的钠盐是一种致癌物质,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.回答下列问题:
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,D的钠盐是一种致癌物质,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.回答下列问题: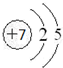 ,A的电子式为
,A的电子式为 ,
,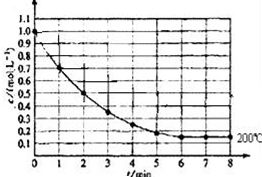 一固定体积的密闭容器中放入1molX(g)发生反应:X(g)?4Y(s)+Z(g),如图表示在 200℃时,X的浓度随时间变化的曲线.
一固定体积的密闭容器中放入1molX(g)发生反应:X(g)?4Y(s)+Z(g),如图表示在 200℃时,X的浓度随时间变化的曲线.