题目内容
一同学用某种粗盐(主要含有泥沙、CaCl2、MgCl2等物质)进行提纯实验,步骤如图所示.
请回答下列问题
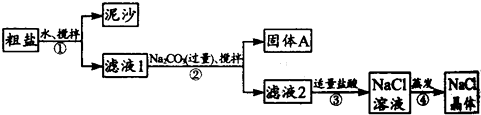
(1)步骤①和②的操作名称是 .
(2)步骤②中加入过量Na2CO3的目的是 ,
固体A中含有的固体是 (写物质的化学式)
(3)步骤③中加入适量盐酸的目的是 ,判断加入盐酸“适量”的方法是 .
(4)步骤④蒸发液体时要用玻璃棒不断搅拌液体,目的是 .
进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯;②固定铁圈位置;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌;⑤停止加热.其正确的操作顺序为 .
请回答下列问题

(1)步骤①和②的操作名称是
(2)步骤②中加入过量Na2CO3的目的是
固体A中含有的固体是
(3)步骤③中加入适量盐酸的目的是
(4)步骤④蒸发液体时要用玻璃棒不断搅拌液体,目的是
进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯;②固定铁圈位置;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌;⑤停止加热.其正确的操作顺序为
考点:粗盐提纯
专题:实验题
分析:(1)根据分离难溶物的操作方法进行解答;
(2)粗盐中含有镁离子和钙离子,加入过量碳酸钠溶液可以除净钙离子和镁离子;沉淀A则为碳酸钙和碳酸镁;
(3)步骤③加入盐酸除去步骤②加入的过量碳酸钠;碳酸钠与盐酸反应生成二氧化碳气体,如果没有气体产生,说明盐酸已经适量;
(4)在蒸发氯化钠溶液时,使用玻璃棒可以使氯化钠溶液受热均匀,避免局部受热;根据蒸发氯化钠溶液的操作方法进行排序.
(2)粗盐中含有镁离子和钙离子,加入过量碳酸钠溶液可以除净钙离子和镁离子;沉淀A则为碳酸钙和碳酸镁;
(3)步骤③加入盐酸除去步骤②加入的过量碳酸钠;碳酸钠与盐酸反应生成二氧化碳气体,如果没有气体产生,说明盐酸已经适量;
(4)在蒸发氯化钠溶液时,使用玻璃棒可以使氯化钠溶液受热均匀,避免局部受热;根据蒸发氯化钠溶液的操作方法进行排序.
解答:
解:(1)步骤①通过过滤除去氯化钠溶液中的泥沙,步骤②通过过滤除去碳酸钠与钙离子、镁离子反应生成的碳酸钙、碳酸镁沉淀,所以步骤①和②的操作名称为过滤,
故答案为:过滤;
(2)粗盐中含有杂质Ca2+和Mg2+,加入过量的碳酸钠溶液可以除净Ca2+和Mg2+,反应生成的沉淀为CaCO3和MgCO3,
故答案为:除净溶液中的Ca2+ 和Mg2+; CaCO3和MgCO3;
(3)步骤②中加入了过量的碳酸钠,步骤③中加入适量盐酸的目的是除去过量的碳酸钠;判断加入盐酸“适量”的方法是溶液中恰好不再产生气体
故答案为:除去过量的Na2CO3;恰好不再产生气体;
(4)步骤④蒸发液体时要用玻璃棒不断搅拌液体,防止局部过热造成液滴飞溅,避免发生危险;进行氯化钠溶液的蒸发操作顺序为:①放置酒精灯、②固定铁圈位置、③放上蒸发皿(蒸发皿中盛有NaCl溶液)、④加热搅拌、⑤停止加热,其正确的操作顺序为:①②③④⑤,
故答案为:防止局部过热造成液滴飞溅;①②③④⑤.
故答案为:过滤;
(2)粗盐中含有杂质Ca2+和Mg2+,加入过量的碳酸钠溶液可以除净Ca2+和Mg2+,反应生成的沉淀为CaCO3和MgCO3,
故答案为:除净溶液中的Ca2+ 和Mg2+; CaCO3和MgCO3;
(3)步骤②中加入了过量的碳酸钠,步骤③中加入适量盐酸的目的是除去过量的碳酸钠;判断加入盐酸“适量”的方法是溶液中恰好不再产生气体
故答案为:除去过量的Na2CO3;恰好不再产生气体;
(4)步骤④蒸发液体时要用玻璃棒不断搅拌液体,防止局部过热造成液滴飞溅,避免发生危险;进行氯化钠溶液的蒸发操作顺序为:①放置酒精灯、②固定铁圈位置、③放上蒸发皿(蒸发皿中盛有NaCl溶液)、④加热搅拌、⑤停止加热,其正确的操作顺序为:①②③④⑤,
故答案为:防止局部过热造成液滴飞溅;①②③④⑤.
点评:本题主要考查了盐的性质、除杂的方法和原则,除去多种杂质时,要考虑加入试剂的顺序,为了保证将杂质除尽,所加试剂必须过量,因此为了不引进新的杂质,后面加入的试剂要能够除去前面所进入的过量试剂.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目
下列化学用语中,表示正确的是( )
A、2s的电子云模型是: |
B、肽键的结构式为: |
C、H2S分子的球棍模型为: |
D、最外层电子排布式为ns2np3对应的轨道表示式为: |
下列关于有机物的叙述正确的是( )
| A、乙醇不能发生取代反应 |
| B、C4H10有三种同分异构体 |
| C、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| D、乙烯和甲烷可用溴的四氯化碳溶液鉴别 |