题目内容
在NaHCO3溶液中,C(H+)+C(Na+)= .C(HCO3-)+C(CO32-)+C(H2CO3)= .
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:在碳酸氢钠溶液中,碳酸氢钠放电电离和水解,其溶液中存在电离平衡和水解平衡,NaHCO3=Na++HCO3-、HCO3-?H++CO32-、HCO3--H2O?H2CO3+OH-,溶液中存在电荷守恒、物料守恒,据此分析解答.
解答:
解:在碳酸氢钠溶液中,碳酸氢钠放电电离和水解,其溶液中存在电离平衡和水解平衡,NaHCO3=Na++HCO3-、HCO3-?H++CO32-、HCO3--H2O?H2CO3+OH-,溶液中存在电荷守恒、物料守恒,根据电荷守恒得C(H+)+C(Na+)=c(OH-)+C(HCO3-)+2C(CO32-),根据物料守恒得C(HCO3-)+C(CO32-)+C(H2CO3)=C(Na+),
故答案为:C(OH-)+C(HCO3-)+2C(CO32-);C(Na+).
故答案为:C(OH-)+C(HCO3-)+2C(CO32-);C(Na+).
点评:本题以盐类水解为载体考查离子浓度大小比较,任何电解质溶液中都存在电荷守恒和物料守恒,与电解质溶液浓度大小无关,与溶液中电解质种类多少无关,题目难度不大.

练习册系列答案
相关题目
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述正确的是( )


| A、1mol维生素P最多可以和4mol溴水发生加成反应 |
| B、可溶于有机溶剂 |
| C、分子中有三个苯环 |
| D、1mol维生素P最多可以和5molNaOH反应 |
工业上合成氨气,已知通入1mol N2和3mol H2,反应过程中共放出a kJ的热量.经测定反应中N2的转化率为20%(已知:N2的转化率=实际反应的N2的量/初始充入N2的总量),则合成氨气的热化学方程式可表示为( )
| A、N2(g)+3H2(g)?2NH3 (g)△H=a kJ/mol |
| B、N2(g)+3H2(g)?2NH3 (g)△H=-a kJ/mol |
| C、N2(g)+3H2(g)?2NH3 (g)△H=5a kJ/mol |
| D、N2(g)+3H2(g)?2NH3(g)△H=-5a kJ/mol |
下列离子检验的方法正确的是( )
| A、某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有Cl- |
| B、某溶液中加BaCl 2溶液生成白色沉淀,说明原溶液中有SO42- |
| C、某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+ |
| D、某溶液中加稀硫酸溶液生成白色沉淀,说明原溶液中有CO32- |
 醋酸是一种常见的弱酸.
醋酸是一种常见的弱酸.




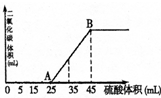 向100mL NaOH溶液中,通入一定量CO2后,然后向该溶液中逐滴加入1mol?L-1硫酸,所加入硫酸溶液体积与产生CO2体积关系如图所示:
向100mL NaOH溶液中,通入一定量CO2后,然后向该溶液中逐滴加入1mol?L-1硫酸,所加入硫酸溶液体积与产生CO2体积关系如图所示: