题目内容
18.下列各组离子在指定条件下能大量共存的是( )| A. | 通入氯气:K+、Fe2+、SO42-、Br- | |
| B. | 通入SO2:Ba2+、NH4+、NO3-、Cl- | |
| C. | 加入氧化钠固体:Mg2+、HCO3-、SO42- | |
| D. | 透明溶液中:Cu2+、Fe3+、NO3-、Cl- |
分析 A.氯气具有强氧化性,能够氧化亚铁离子和溴离子;
B.酸性条件下硝酸根离子能够氧化二氧化硫;
C.氧化钠与水反应生成氢氧化钠,氢氧化钠与镁离子、碳酸氢根离子反应;
D.四种离子之间不反应,能够共存.
解答 解:A.通入氯气后,氯气能够氧化Fe2+、Br-,通入氯气后不能共存,故A错误;
B.通入SO2,Ba2+、SO2、NO3-之间反应生成硫酸钡沉淀,在溶液中不能大量共存,故B错误;
C.加入氧化钠固体生成氢氧化钠,氢氧化钠与Mg2+、HCO3-反应,不能共存,故C错误;
D.Cu2+、Fe3+、NO3-、Cl-之间不发生反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;D为易错点,注意“透明溶液”不是无色溶液.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
8.关于苯和苯酚的叙述中正确的是( )
| A. | 实验室制硝基苯时,将硝酸与苯混合后再滴加浓硫酸 | |
| B. | 在苯中加入酸性KMnO4溶液,振荡并静置后下层液体为紫色 | |
| C. | 苯酚钠溶液中通入少量二氧化碳生成苯酚和碳酸钠 | |
| D. | 实验时手指不小心沾上苯酚,立即用70℃以上的热水清洗 |
6.现有部分短周期元素的性质或原子结构如下表
(1)元素T的阴离子的结构示意图 .
.
(2)元素Y在周期表中的位置是第二周期ⅤA族.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示).下列表述中能证明这一事实的是bce.
a.常温下Z的单质和T的单质状态不同 b.Z的氢化物比T的氢化物稳定
c.Z的最高价氧物所对应的水化物比T的最高价氧化物所对应的水化物的酸性强
d.Z的氢化物笔比T的氢化物溶解度大
e.Z的单质与H2化合比T的单质与H2化合更容易
(4)结合所学的知识,请设计一个与(3)中的事实不同的实验方案证明元素Z与元素T的非金属性的强弱将氯气通入到Na2S溶液中,若产生淡黄色沉淀,则证明非金属性Cl>S.
| 元素编号 | 元素性质或原子结构 |
| T | M层的电子数为K层电子数的3倍 |
| X | 其化合物的种类最多且其氢化物是一种清洁能源 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价+7价 |
 .
.(2)元素Y在周期表中的位置是第二周期ⅤA族.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示).下列表述中能证明这一事实的是bce.
a.常温下Z的单质和T的单质状态不同 b.Z的氢化物比T的氢化物稳定
c.Z的最高价氧物所对应的水化物比T的最高价氧化物所对应的水化物的酸性强
d.Z的氢化物笔比T的氢化物溶解度大
e.Z的单质与H2化合比T的单质与H2化合更容易
(4)结合所学的知识,请设计一个与(3)中的事实不同的实验方案证明元素Z与元素T的非金属性的强弱将氯气通入到Na2S溶液中,若产生淡黄色沉淀,则证明非金属性Cl>S.
3.下列物质的结构或性质描述正确的是( )
| A. | 甲烷和氯气可以发生取代反应 | B. | 乙烯和高锰酸钾可以发生加成反应 | ||
| C. | 酯化反应中醇脱羟基酸脱氢 | D. | 乙醇可以发生银镜反应 |
8.丁烷、丙烯、乙炔分子中碳碳键键能总和大小关系是( )
| A. | 丁烷>丙烯>乙炔 | B. | 乙炔>丙烯>丁烷 | C. | 丙烯>丁烷>乙炔 | D. | 丁烷=丙烯=乙炔 |
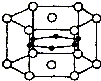 图为硼和镁两种元素组成的超导材料的晶体结构单元示意图,其中该化合物镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内.则该化合物的化学式可表示为MgB2.
图为硼和镁两种元素组成的超导材料的晶体结构单元示意图,其中该化合物镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内.则该化合物的化学式可表示为MgB2. 和
和  ;⑧丙烷和环丙烷.用序号填空:
;⑧丙烷和环丙烷.用序号填空: