题目内容
18.常温下,把pH=11的氢氧化钠溶液与pH=3的醋酸溶液等体积混合,在所得溶液中离子浓度大小关系是c(CH3COO-)>c(Na+)>c(H+)>c(OH-).分析 醋酸为弱酸,pH=3的醋酸与pH=11的氢氧化钠溶液混合后,醋酸过量,溶液显示酸性,根据电荷守恒进行判断钠离子与醋酸根离子浓度关系.
解答 解:pH=3的醋酸与pH=11的氢氧化钠溶液混合后,醋酸为弱酸,所以醋酸过量,溶液显示酸性,氢离子浓度大于氢氧根离子浓度c(H+)>c(OH-),根据电荷守恒可知,c(Na+)<c(CH3COO-),即c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
点评 本题考查了酸碱混合时溶液酸碱性判断及溶液离子浓度大小比较的方法,注意醋酸为弱电解质,在溶液中部分电离.

练习册系列答案
相关题目
8.分类是学习和研究化学的一种重要方法.下列分类合理的是( )
| A. | 纯碱和烧碱都属于碱 | B. | 小苏打和苏打都属于盐 | ||
| C. | SO2和HNO3都属于酸 | D. | Na2O2和Na2SiO3都属于氧化物 |
9.居民所用石油液化气的主要成分是丁烷,在使用过程中,常有一些杂质以液态沉积于钢瓶中,这些杂质是( )
| A. | 甲烷和丙烷 | B. | 乙烷和甲醛 | C. | 乙烷和丁烷 | D. | 戊烷和己烷 |
6.有8种物质:①甲烷、②苯、③聚乙烯、④1,3-丁二烯、⑤2-丁炔、⑥己烷.其中能使酸性高锰酸钾溶液褪色的是( )
| A. | ①②③ | B. | ②⑥ | C. | ③④⑤ | D. | ④⑤ |
13.已知正丁烷、异丁烷燃烧的热化学方程式分别为:
CH3CH2CH2CH3(g)+$\frac{13}{2}$O2(g)→4CO2(g)+5H2O(l)△H=-2878kJ•mol-1
(CH3)2CHCH3(g)+$\frac{13}{2}$O2(g)→4CO2(g)+5H2O(l)△H=-2869kJ•mol-1
则下列说法正确的是( )
CH3CH2CH2CH3(g)+$\frac{13}{2}$O2(g)→4CO2(g)+5H2O(l)△H=-2878kJ•mol-1
(CH3)2CHCH3(g)+$\frac{13}{2}$O2(g)→4CO2(g)+5H2O(l)△H=-2869kJ•mol-1
则下列说法正确的是( )
| A. | 正丁烷的燃烧热大于异丁烷,故正丁烷分子中的碳氢键比异丁烷的多 | |
| B. | 正丁烷的稳定性大于异丁烷 | |
| C. | 正丁烷转化为异丁烷的过程是一个放热过程 | |
| D. | 正丁烷分子储存的能量小于异丁烷分子 |
3.下列图示与对应的叙述相符的是( )


| A. | 图甲表示温度T1>T2,SO2与O2反应过程中的能量变化 | |
| B. | 图乙表示0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L CH3COOH溶液所得到的滴定曲线 | |
| C. | 图丙表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 | |
| D. | 图丁表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则aHCl表示溶液 |
10.某有机物的结构式如图所示,下列关于该有机物的说法正确的是( )
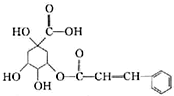

| A. | 分子式为C16H16O7 | |
| B. | 能与钠、乙醇、乙酸、溴发生反应,不能与碳酸钠发生反应 | |
| C. | 能发生取代反应、氧化反应、加成反应,不能发生水解发应 | |
| D. | 1mol 该有机物最多能与2mol NaOH或4mol H2发生反应 |
7.下列各组物质中,所含化学键类型完全相同的是( )
| A. | HCl和MgCl2 | B. | H2O和CO2 | C. | NH4Cl和CCl4 | D. | HCl和NaOH |
8.分别进行如下表所示实验,现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈红色 | 稀硝酸不能将Fe氧化为Fe3+ |
| B | NaAlO2溶液中滴入NaHCO3溶液 | 产生白色沉淀 | AlO2-与HCO3-发生双水解反应 |
| C | 向某溶液里滴加稀NaOH溶液并将湿润的红色石蕊试纸置于试管口 | 试纸颜色没变 | 原溶液中无NH4+ |
| D | 将0.1mol•L-1MgSO4溶液滴入到NaOH溶液里至不再有沉淀产生,再滴加0.1mol•L-1CuSO4溶液 | 先有白色沉淀生成,后变为蓝色沉淀 | Cu(OH)2的Ksp比Mg(OH)2的Ksp小 |
| A. | A | B. | B | C. | C | D. | D |