题目内容
四种X溶液分别加入四个盛有10 mL 2 mol/L盐酸的烧杯中,均加水稀释到50 mL,假设混合和稀释是瞬间完成的,则开始的瞬间反应速率最大的是( )
A.20 mL 2 mol/L 的X溶液 B.10 mL 4 mol/L 的X溶液
C.20 mL 3 mol/L 的X溶液 D.10 mL 2 mol/L 的X溶液
练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
4.如图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子是Ar
(2)地壳中含量最多的金属元素是Al;非金属性最强的元素F
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(4)在这些元素中,原子半径最小的是F,原子半径最大的是K.①的最高价氧化物对应的水化物的化学式为HNO3,其稀溶液与铜反应的化学方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.当有0.4mol该物质被还原,则转移的电子为0.3mol.
(5)①、②、③所形成的气体氢化物的稳定性由强到弱的顺序HF>H2O>NH3
(6)完成下列反应的化学方程式:⑦的氧化物与氢氧化钠溶液反应SiO2+2NaOH=Na2SiO3+H2O,④、⑥的最高价氧化物对应的水化物两两反应:Al(OH)3+NaOH=NaAlO2+2H2O.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 四 | ⑩ |
(2)地壳中含量最多的金属元素是Al;非金属性最强的元素F
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(4)在这些元素中,原子半径最小的是F,原子半径最大的是K.①的最高价氧化物对应的水化物的化学式为HNO3,其稀溶液与铜反应的化学方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.当有0.4mol该物质被还原,则转移的电子为0.3mol.
(5)①、②、③所形成的气体氢化物的稳定性由强到弱的顺序HF>H2O>NH3
(6)完成下列反应的化学方程式:⑦的氧化物与氢氧化钠溶液反应SiO2+2NaOH=Na2SiO3+H2O,④、⑥的最高价氧化物对应的水化物两两反应:Al(OH)3+NaOH=NaAlO2+2H2O.
下列实验操作能达到实验目的的是( )
选项 | 实验目的 | 实验操作 |
A | 除去CO2中少量的CO | 点燃 |
B | 除去CuSO4溶液中的少量FeSO4 | 加入足量的铜粉 |
C | 鉴别澄清石灰水和NaOH溶液 | 加入稀盐酸 |
D | 鉴别硬水和软水 | 加入肥皂水 |
14.下列说法正确的是( )
| A. | 第3层最多能容纳32个电子 | |
| B. | 磷原子的结构示意图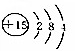 | |
| C. | 第2周期元素的最高正价从+1递增到+7 | |
| D. | 同周期主族元素的原子半径随原子序数的递增而逐渐减小 |


