题目内容
6.下列实验的操作、现象和解释或结论都正确的是( )| 操作 | 现象 | 解释或结论 | |
| A | 将饱和Na2SO4溶液加入到饱和石灰水 | 有白色沉淀 | 有Na2SO4晶体析出 |
| B |  | 试剂瓶中有一段稳定水柱 | 装置气密性良好 |
| C | 将Al2(SO4)3溶液蒸干 | 有白色固体生成 | A13+水解生成Al(OH)3 |
| D |  | 锥形瓶溶液产生淡黄色沉淀 | 苯与溴发生取代反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.反应生成的白色沉淀为硫酸钙,不是硫酸钠;
B.气体受热膨胀,导致集气瓶中压强增大,导管中有水柱生成,若形成水柱在一端时间内不变,则该装置气密性良好;
C.硫酸不挥发,最终得到的仍然为硫酸铝;
D.溴具有挥发性,干扰了检验结果.
解答 解:A.将饱和Na2SO4溶液加入到饱和石灰水,反应生成硫酸钙沉淀,没有有Na2SO4晶体析出,故A错误;
B.若图示装置的试剂瓶中有一段稳定水柱,能够证明该装置气密性良好,故B正确;
C.将Al2(SO4)3溶液蒸干,由于硫酸不具有挥发性,则最终得到的仍然为Al2(SO4)3,不会得到Al(OH)3,故C错误;
D.挥发出来的溴单质也能够与硝酸银溶液反应生成淡黄色的溴化银沉淀,无法证明苯与溴发生了取代反应,故D错误;
故选B.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及装置气密性检查、盐的水解原理、离子检验等知识,明确盐的水解原理为解答关键,D为易错点,注意溴单质易挥发,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
17.下列说法正确的是( )
| A. | s电子云是在空间各个方向上延展程度相同的对称形状 | |
| B. | p电子云是“8”字形的 | |
| C. | 2p能级有一个未成对电子的基态原子的电子排布式一定为1s22s22p5 | |
| D. | 2d能级包含5个原子轨道,最多容纳10个电子 |
14.下列说法正确的是( )
| A. | 第3层最多能容纳32个电子 | |
| B. | 磷原子的结构示意图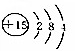 | |
| C. | 第2周期元素的最高正价从+1递增到+7 | |
| D. | 同周期主族元素的原子半径随原子序数的递增而逐渐减小 |
1.向一定量的FeO、Fe、Fe2O3的混合物中加入100mL 1mol/L盐酸,恰好使混合物完全溶解,放出112mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现.若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量为( )
| A. | 2.8g | B. | 5.6g | C. | 8.4g | D. | 无法计算 |
11.短周期主族元素X,Y,Z,W的原子序数依次增大,X,Y的原子序数之和等于Z的原子序数;Y,Z为同周期相邻元素;X,W,Y分别排列在三个连续的奇数族,下列说法正确的( )
| A. | 简单离子半径:Y>Z>W | |
| B. | 最高价氧化物对应水化物的酸性:Y<Z | |
| C. | X分别与Y,Z形成的最简单化合物均属于电解质 | |
| D. | 工业上制备W单质的方法为电解熔融的W的氯化物 |
18.下列有关判断正确的是( )
| A. | 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 | |
| B. | 将pH=a的醋酸稀释为pH=a+1的过程中,$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$变大 | |
| C. | 常温下,2NO(g)+O2(g)=2NO2(g)能够自发进行,则该反应的△H<0 | |
| D. | 向AgCl浊液中加入少量NaCl饱和溶液,则c(Ag+),Ksp(AgCl)均减小 |
15.下列关于有机物M( )的说法不正确的是( )
)的说法不正确的是( )
 )的说法不正确的是( )
)的说法不正确的是( )| A. | 分子式为C15H14O4 | |
| B. | 苯环上的一氯代物有7种 | |
| C. | 能发生氧化反应和取代反应 | |
| D. | 1mol M与足量的Na反应,最多消耗3mol Na |
13.下列实验方案中,能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 配制100mL1.0mol/LCuSO4溶液 | 将25g CuSO4•5H2O溶于100mL蒸馏水中 |
| B | 除去CuO中混有的Al2O3 | 加入过量NaOH溶液后,过滤、洗涤、干燥 |
| C | 证明氧化性:H2O2>Fe3+ | 强硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
| D | 证明非金属性:Cl>C | 向NaHCO3溶液中加入过量盐酸振荡、静置、观察 |
| A. | A | B. | B | C. | C | D. | D |