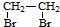题目内容
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理.
Ⅰ.染料工业排放的废水中含有大量有毒的NO2?,可以在碱性条件下加入铝粉除去(加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体).除去NO2-的离子方程式为 .
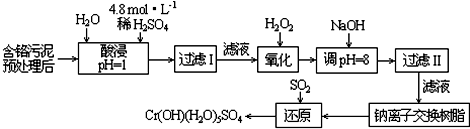
Ⅱ.某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
(1)实验室用18.4mol?L-1的浓硫酸配制250mL 4.8mol?L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需 .
(2)加入H2O2的作用是 .
(3)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是 (选填:Fe3+、Al3+、Ca2+、Mg2+).
Ⅲ.印刷电路铜板腐蚀剂常用FeCl3.腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol?L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤① ② ③过滤.(提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu)
Ⅰ.染料工业排放的废水中含有大量有毒的NO2?,可以在碱性条件下加入铝粉除去(加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体).除去NO2-的离子方程式为
Ⅱ.某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
(2)加入H2O2的作用是
(3)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是
Ⅲ.印刷电路铜板腐蚀剂常用FeCl3.腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol?L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤①
考点:物质分离和提纯的方法和基本操作综合应用,探究物质的组成或测量物质的含量
专题:实验设计题
分析:Ⅰ、铝与强碱能反应生成偏铝酸盐,高中学过的能使湿润的红色石蕊试纸变蓝的气体是氨气,由此判断该反应的生成物,从而写出离子方程式.
Ⅱ、硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+,加入过氧化氢氧化铬离子为高价态,加入氢氧化钠溶液调节溶液PH使其他离子沉淀,过滤得到滤液用钠离子交换树脂交换镁离子和钙离子,得到 溶液中通入二氧化硫还原得到Cr(OH)(H2O)5SO4;
(1)配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、吸量管、容量瓶和胶头滴管;
(2)根据双氧水的性质分析,双氧水有强氧化性,能氧化还原性的物质;
(3)钠离子交换树脂交换 的离子是钙离子和镁离子;
Ⅲ、除杂的原则是:除去杂质且不引进新的杂质,除去CuCl2溶液中Fe3+和Fe2+,必须先使Fe2+转化为Fe3+,再加入氧化铜除去多余的氯气,调节溶液的PH值,使Fe3+完全转化为氢氧化铁从而除去溶液中的Fe3+.
Ⅱ、硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+,加入过氧化氢氧化铬离子为高价态,加入氢氧化钠溶液调节溶液PH使其他离子沉淀,过滤得到滤液用钠离子交换树脂交换镁离子和钙离子,得到 溶液中通入二氧化硫还原得到Cr(OH)(H2O)5SO4;
(1)配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、吸量管、容量瓶和胶头滴管;
(2)根据双氧水的性质分析,双氧水有强氧化性,能氧化还原性的物质;
(3)钠离子交换树脂交换 的离子是钙离子和镁离子;
Ⅲ、除杂的原则是:除去杂质且不引进新的杂质,除去CuCl2溶液中Fe3+和Fe2+,必须先使Fe2+转化为Fe3+,再加入氧化铜除去多余的氯气,调节溶液的PH值,使Fe3+完全转化为氢氧化铁从而除去溶液中的Fe3+.
解答:
解:Ⅰ、根据题意知,能使湿润的红色石蕊试纸变蓝的气体是氨气,铝与强碱能反应生成偏铝酸盐,铝是还原剂,NO2-是氧化剂,所以能发生氧化还原反应生成偏铝酸盐和氨水,离子方程式为:2Al+OH-+NO2-+2H2O=2AlO2-+NH3?H2O,故答案为:2Al+OH-+NO2-+2H2O=2AlO2-+NH3?H2O;
Ⅱ、(1)配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、吸量管、容量瓶和胶头滴管,故答案为:250mL容量瓶、胶头滴管;
(2)双氧水有强氧化性,能氧化还原性的物质,Cr3+有还原性,Cr3+能被双氧水氧化为高价离子,以便于与杂质离子分离,
故答案为:将Cr3+转变成较高价态的铬,以便于与杂质离子分离;
(3)钠离子交换树脂交换 的离子是钙离子和镁离子,故答案为:Ca2+、Mg2+;
Ⅲ.①除去CuCl2溶液中Fe3+和Fe2+,根据生成沉淀所需溶液 的PH值知,若使Fe2+转化为沉淀时,铜离子已经完全沉淀,所以不符合题意,故首先把Fe2+转化为Fe3+,加入氧化剂且不引进新的杂质,所以首先要通入足量氯气将Fe2+氧化成Fe3+;
故答案为:通入足量氯气将Fe2+氧化成Fe3+;
②通入足量氯气后,溶液呈酸性,所以要加入某种物质除去溶液中的酸且不引进新的杂质,所以要加入氧化铜,使酸转化为氯化铜,当溶液的pH值4.7时,铜离子开始出现沉淀,当溶液的pH值为3.2时,三价铁离子沉淀完全,铜离子未产生沉淀,所以要使三价铁离子和铜离子分离,溶液的pH值应为[3.2,4.7);
故答案为:加入CuO调节溶液的pH至[3.2,4.7).
Ⅱ、(1)配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、吸量管、容量瓶和胶头滴管,故答案为:250mL容量瓶、胶头滴管;
(2)双氧水有强氧化性,能氧化还原性的物质,Cr3+有还原性,Cr3+能被双氧水氧化为高价离子,以便于与杂质离子分离,
故答案为:将Cr3+转变成较高价态的铬,以便于与杂质离子分离;
(3)钠离子交换树脂交换 的离子是钙离子和镁离子,故答案为:Ca2+、Mg2+;
Ⅲ.①除去CuCl2溶液中Fe3+和Fe2+,根据生成沉淀所需溶液 的PH值知,若使Fe2+转化为沉淀时,铜离子已经完全沉淀,所以不符合题意,故首先把Fe2+转化为Fe3+,加入氧化剂且不引进新的杂质,所以首先要通入足量氯气将Fe2+氧化成Fe3+;
故答案为:通入足量氯气将Fe2+氧化成Fe3+;
②通入足量氯气后,溶液呈酸性,所以要加入某种物质除去溶液中的酸且不引进新的杂质,所以要加入氧化铜,使酸转化为氯化铜,当溶液的pH值4.7时,铜离子开始出现沉淀,当溶液的pH值为3.2时,三价铁离子沉淀完全,铜离子未产生沉淀,所以要使三价铁离子和铜离子分离,溶液的pH值应为[3.2,4.7);
故答案为:加入CuO调节溶液的pH至[3.2,4.7).
点评:本题考查了离子方程式的书写、物质的分离等知识点,难度中等,注意会运用溶液的PH值对溶液中的离子进行分离,除杂的原则是:除去杂质且不引进新的杂质.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
无土栽培技术研究配制一种营养液,此1L营养液中含0.5molNH4Cl、0.16molKCl、0.24molK2SO4.若用KCl、NH4Cl和(NH4)2SO4三种固体来配制,则每升溶液中需三种固体的物质的量依次为( )
| A、0.32mol、0.5mol、0.12mol |
| B、0.02mol、0.64mol、0.24mol |
| C、0.64mol、0.02mol、0.24mol |
| D、0.16mol、0.5mol、0.24mol |
据报道,科学家已成功合成了少量H3,有关H3的说法正确的是( )
| A、H3和H2互为氢元素的两种核素 |
| B、H3是氢元素的一种同位素 |
| C、相同体积的H3和H2气体所含分子数比为1:1 |
| D、H3的摩尔质量是3 g?mol-1 |
乙醇和乙酸乙酯组成的混合物中,已知其中氧的质量分数为36%,则100g此混合物完全燃烧后生成水的质量为( )
| A、104g | B、90g |
| C、92g | D、88g |
有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化学工业的发展水平.A、B、C、D、E有下图所示的关系.则下列推断不正确的是( )
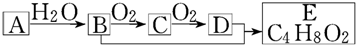
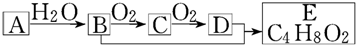
| A、A→B属于加成反应 | |||
| B、B、D均能与金属钠反应 | |||
| C、物质C的结构简式为CH3CHO | |||
D、生成E的化学方程式为:CH3CH2OH+CH3COOH
|
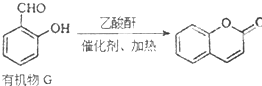
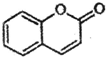 ) 是一种存在于某些植物的果、花等中的天然香料.又知:
) 是一种存在于某些植物的果、花等中的天然香料.又知: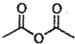 ;
;
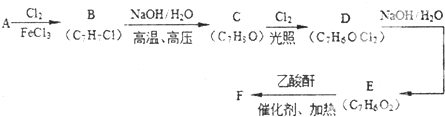
 (是一种常用有机溶剂)的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
(是一种常用有机溶剂)的合成路线流程图(无机试剂任用).合成路线流程图示例如下: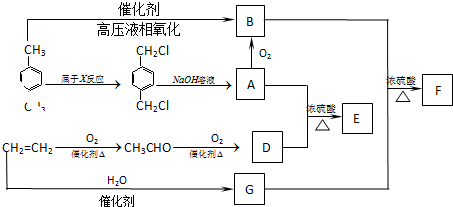
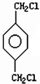 →A:
→A: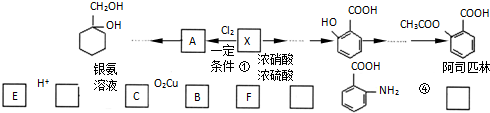

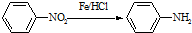 (苯胺,易被氧化)
(苯胺,易被氧化) 的合成路线流程图(无机试剂任用).合成路线流程图示例如:CH3CH2OH
的合成路线流程图(无机试剂任用).合成路线流程图示例如:CH3CH2OH