题目内容
乙醇和乙酸乙酯组成的混合物中,已知其中氧的质量分数为36%,则100g此混合物完全燃烧后生成水的质量为( )
| A、104g | B、90g |
| C、92g | D、88g |
考点:有关混合物反应的计算
专题:计算题
分析:根据乙醇(C2H6O)、乙酸乙酯(C4H8O2)的分子式可知,两者碳氧质量比例相同,m(C):m(O)=24:16=3:2(质量比),根据O的质量分数计算出C的质量分数,H的质量分数ω(H)=1-ω(C)-ω(O),进而计算生成水的质量,以此解答该题.
解答:
解:根据乙醇(C2H6O)、乙酸乙酯(C4H8O2)的分子式可知,两者碳氧质量比例相同,
所以m(C):m(O)=24:16=3:2(质量比)
由于ω(O)=36%,所以ω(C)=
×36%=54%,
所以混合物中含氢的质量分数为ω(H)=1-ω(C)-ω(O)=1-54%-36%=10%.
则100g此混合物含有m(H)=100g×10%=10g,n(H)=
=10mol,
则可生成5mol水,质量为5mol×18g/mol=90g,
故选B.
所以m(C):m(O)=24:16=3:2(质量比)
由于ω(O)=36%,所以ω(C)=
| 3 |
| 2 |
所以混合物中含氢的质量分数为ω(H)=1-ω(C)-ω(O)=1-54%-36%=10%.
则100g此混合物含有m(H)=100g×10%=10g,n(H)=
| 10g |
| 1g/mol |
则可生成5mol水,质量为5mol×18g/mol=90g,
故选B.
点评:本题考查混合物中元素的质量分数的计算,侧重于学生的分析能力和计算能力的考查,难度中等,关键是利用混合物中各成分的化学式得出C、O的质量比例相同.

练习册系列答案
相关题目
反应2NO+2CO
N2+2CO2可应用于汽车尾气的净化.下列判断正确的是( )
| ||
| A、该反应是置换反应 |
| B、该反应是复分解反应 |
| C、CO是氧化剂 |
| D、NO发生还原反应 |
成语言简意赅,是中华民族智慧的结晶.下列成语描绘的变化属于化学变化的是( )
| A、点石成金 | B、水滴石穿 |
| C、滴水成冰 | D、拨云见日 |
下列物质既有氧化性又有还原性的是( )
| A、Fe |
| B、FeCl2 |
| C、Fe3+ |
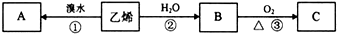
 有A、B、C、D、F、G六种短周期主族元素,它们的原子序数依次增大.B元素的最高正价与最低负价的绝对值相等,D元素原子最外层电子数是次外层电子数的3倍,F元素在地壳中含量居第二位;A与B、C、D分别构成电子数相等的分子Q、X、Y;化合物AG在空气中与X反应产生白烟Z.
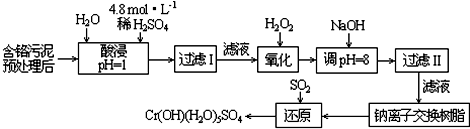
有A、B、C、D、F、G六种短周期主族元素,它们的原子序数依次增大.B元素的最高正价与最低负价的绝对值相等,D元素原子最外层电子数是次外层电子数的3倍,F元素在地壳中含量居第二位;A与B、C、D分别构成电子数相等的分子Q、X、Y;化合物AG在空气中与X反应产生白烟Z.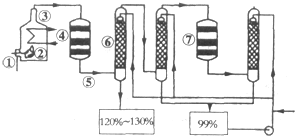 如图是现今常规生产发烟硫酸和硫酸的流程图:
如图是现今常规生产发烟硫酸和硫酸的流程图: