题目内容
铝土矿的主要成分是Al2O3,还含有Fe2O3、SiO2等杂质.

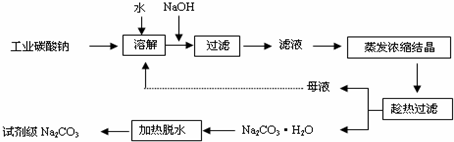
Ⅰ.从铝土矿中提取氧化铝的流程如图所示:
(1)试剂A是 ;
(2)向溶液a中通入过量的CO2,将得到的不溶物煅烧后也可得到Al2O3,该方案的缺点是 .
Ⅱ.电解熔融的氧化铝可制备金属铝
(3)写出电解的化学方程式 .
Ⅲ.新型陶瓷氮化铝可用以下两种方法制备
(4)①氧化铝高温还原法: Al2O3+ C+ N2
AlN+ CO(配平)
②氯化铝与氨气高温合成法:AlCl3+NH3
AlN+3HCl
(5)方法②比方法①在生产上更具优势.下列说法中,正确的是 .
A.方法①中的Al2O3和C容易残留在氮化铝中
B.两种方法中氮化铝均为还原产物.

Ⅰ.从铝土矿中提取氧化铝的流程如图所示:
(1)试剂A是
(2)向溶液a中通入过量的CO2,将得到的不溶物煅烧后也可得到Al2O3,该方案的缺点是
Ⅱ.电解熔融的氧化铝可制备金属铝
(3)写出电解的化学方程式
Ⅲ.新型陶瓷氮化铝可用以下两种方法制备
(4)①氧化铝高温还原法:
| ||
②氯化铝与氨气高温合成法:AlCl3+NH3
| ||
(5)方法②比方法①在生产上更具优势.下列说法中,正确的是
A.方法①中的Al2O3和C容易残留在氮化铝中
B.两种方法中氮化铝均为还原产物.
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能,该工艺流程原理为:铝土矿加入试剂A氢氧化钠,得到滤液a中含有偏铝酸根离子、硅酸根离子,沉淀a为氧化铁,a溶液加入过量为酸溶液,除去硅酸根离子,将偏铝酸根离子转化为铝离子,进入滤液b中,加过量氨水生成氢氧化铝沉淀,加热分解得氧化铝,
Ⅰ.(1)根据流程可知,加入试剂A目的是引进氢离子除去硅酸根离子;
(2)滤液a中含有偏铝酸根离子、硅酸根离子,制氧化铝的过程中可能会混有二氧化硅杂质;
Ⅱ.(3)电解熔融的氧化铝可制备金属铝,阳极生成氧气,阴极生成铝,产物为铝和氧气;
Ⅲ.(4)根据化合价的升降总数相等配平方程式;
(5)根据反应原理①②对A、B进行判断.
Ⅰ.(1)根据流程可知,加入试剂A目的是引进氢离子除去硅酸根离子;
(2)滤液a中含有偏铝酸根离子、硅酸根离子,制氧化铝的过程中可能会混有二氧化硅杂质;
Ⅱ.(3)电解熔融的氧化铝可制备金属铝,阳极生成氧气,阴极生成铝,产物为铝和氧气;
Ⅲ.(4)根据化合价的升降总数相等配平方程式;
(5)根据反应原理①②对A、B进行判断.
解答:
解:由工艺流程原理为:铝土矿加入试剂A氢氧化钠,得到滤液a中含有偏铝酸根离子、硅酸根离子,沉淀a为氧化铁,a溶液加入过量为酸溶液,除去硅酸根离子,将偏铝酸根离子转化为铝离子,进入滤液b中,加过量氨水生成氢氧化铝沉淀,加热分解得氧化铝,
Ⅰ.(1)铝土矿与氢氧化钠反应生成偏铝酸钠,加入盐酸或硝酸等酸性溶液可除去硅酸根离子,所以试剂A为盐酸(硫酸或硝酸),
故答案为:盐酸(硫酸或硝酸);
(2)滤液a中含有偏铝酸根离子、硅酸根离子,向溶液a中通入过量的CO2,沉淀为Al(OH)3及少量硅酸,煅烧得到与和二氧化硅,则Al2O3中含有SiO2杂质,
故答案为:Al2O3中含有SiO2杂质;
Ⅱ.(3)电解熔融的氧化铝可制备金属铝,阳极生成氧气,阴极生成铝,总反应为:2Al2O3(熔融)
4Al+3O2↑,
故答案为:2Al2O3(熔融)
4Al+3O2↑;
Ⅲ.(4)碳从0价→+2价,氮从0价→-3价,最小公倍数为6,由化合价的升降总数相等可知反应的方程式为:Al2O3+3C+N2═2AlN+3CO,
故答案为:1;3;1;2;3;
(5)A.根据反应原理可知,方法①中的Al2O3和C都是固体,二者容易残留在氮化铝中,故A正确;
B.方法①中氮化铝为氮气被还原生成的,方法②不属于氧化还原反应,故B错误;
故答案为:A.
Ⅰ.(1)铝土矿与氢氧化钠反应生成偏铝酸钠,加入盐酸或硝酸等酸性溶液可除去硅酸根离子,所以试剂A为盐酸(硫酸或硝酸),
故答案为:盐酸(硫酸或硝酸);
(2)滤液a中含有偏铝酸根离子、硅酸根离子,向溶液a中通入过量的CO2,沉淀为Al(OH)3及少量硅酸,煅烧得到与和二氧化硅,则Al2O3中含有SiO2杂质,
故答案为:Al2O3中含有SiO2杂质;
Ⅱ.(3)电解熔融的氧化铝可制备金属铝,阳极生成氧气,阴极生成铝,总反应为:2Al2O3(熔融)
| ||
故答案为:2Al2O3(熔融)
| ||
Ⅲ.(4)碳从0价→+2价,氮从0价→-3价,最小公倍数为6,由化合价的升降总数相等可知反应的方程式为:Al2O3+3C+N2═2AlN+3CO,
故答案为:1;3;1;2;3;
(5)A.根据反应原理可知,方法①中的Al2O3和C都是固体,二者容易残留在氮化铝中,故A正确;
B.方法①中氮化铝为氮气被还原生成的,方法②不属于氧化还原反应,故B错误;
故答案为:A.
点评:本题以氧化铝提取工艺流程为载体,考查无机物推断、元素化合物性质及相互转化、氧化还原、离子方程式等知识点,题目难度中等,注意把握制备原理,把握物质的性质以及相关反应方程式的书写.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式的书写正确的是( )
| A、铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、硫酸和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
| C、稀硝酸滴在碳酸钙上:CO32-+2H+═CO2↑+H2O |
| D、二氧化碳通入澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O |
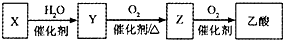 某石油化工产品X的转化关系如图,下列判断正确的是( )
某石油化工产品X的转化关系如图,下列判断正确的是( )| A、X与H2O生成Y的反应是加成反应 |
| B、1 mol Y与足量金属钠反应,能生成3 mol H2 |
| C、Z与CH3OCH3互为同分异构体 |
| D、0.1 mol?L-1乙酸溶液pH为1 |
鉴别苯酚溶液、己烷、己烯、乙酸溶液和乙醇液体,可选用的最佳试剂是( )
| A、石蕊试液、溴水 |
| B、溴水、新制的Cu(OH)2 |
| C、FeCl3溶液、金属钠、溴水、石蕊试液 |
| D、KMnO4酸性溶液、石蕊试液 |