题目内容
已知乙是制氯乙烯的基础原料,在一定条件下,下列物质间可发生如图所示的转化:
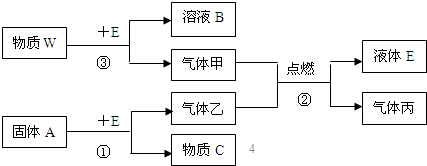
请回答下列问题:
(1)若W为淡黄色固体,则W的电子式为 ;若常温下W为气体,写出反应③的化学方程式 ;
(2)写出反应①的化学方程式: ;
(3)写出图中反应②的化学方程式: ;
(4)写出过量的气体丙通入C的不饱和溶液中的离子反应方程式: .

请回答下列问题:
(1)若W为淡黄色固体,则W的电子式为
(2)写出反应①的化学方程式:
(3)写出图中反应②的化学方程式:
(4)写出过量的气体丙通入C的不饱和溶液中的离子反应方程式:
考点:无机物的推断
专题:有机物的化学性质及推断
分析:已知乙是制氯乙烯的基础原料,则乙为HC≡CH,固体A与液体E反应生成乙炔,则A为CaC2,E为H2O,C为Ca(OH)2,气体甲与乙炔反应生成水与气体丙,则甲为氧气,丙为二氧化碳,W与水反应生成氧气与B,若W为淡黄色固体,则W为Na2O2,对应的B为NaOH,若常温下W为气体,则W为F2,对应的B为HF,据此解答.
解答:
解:已知乙是制氯乙烯的基础原料,则乙为HC≡CH,固体A与液体E反应生成乙炔,则A为CaC2,E为H2O,C为Ca(OH)2,气体甲与乙炔反应生成水与气体丙,则甲为氧气,丙为二氧化碳,W与水反应生成氧气与B,若W为淡黄色固体,则W为Na2O2,对应的B为NaOH,若常温下W为气体,则W为F2,对应的B为HF,
(1)由上述分析可知,若W为淡黄色固体,则W为Na2O2,其电子式为 ;若常温下W为气体,则W为F2,反应③的化学方程式为:2F2+2H2O=4HF+O2,
;若常温下W为气体,则W为F2,反应③的化学方程式为:2F2+2H2O=4HF+O2,
故答案为: ;2F2+2H2O=4HF+O2;
;2F2+2H2O=4HF+O2;
(2)反应①是碳化钙与水反应生成氢氧化钙与乙炔,反应化学方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O=Ca(OH)2+C2H2↑;
(3)反应②是乙炔燃烧生成二氧化碳与水,反应化学方程式为:2C2H2+5O2
4CO2+2H2O,
故答案为:2C2H2+5O2
4CO2+2H2O;
(4)过量的二氧化碳通入氢氧化钙的不饱和溶液生成碳酸氢钙,反应离子反应方程式为:OH-+CO2=HCO3-,故答案为:OH-+CO2=HCO3-.
(1)由上述分析可知,若W为淡黄色固体,则W为Na2O2,其电子式为
 ;若常温下W为气体,则W为F2,反应③的化学方程式为:2F2+2H2O=4HF+O2,
;若常温下W为气体,则W为F2,反应③的化学方程式为:2F2+2H2O=4HF+O2,故答案为:
 ;2F2+2H2O=4HF+O2;
;2F2+2H2O=4HF+O2;(2)反应①是碳化钙与水反应生成氢氧化钙与乙炔,反应化学方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O=Ca(OH)2+C2H2↑;
(3)反应②是乙炔燃烧生成二氧化碳与水,反应化学方程式为:2C2H2+5O2
| 点燃 |
故答案为:2C2H2+5O2
| 点燃 |
(4)过量的二氧化碳通入氢氧化钙的不饱和溶液生成碳酸氢钙,反应离子反应方程式为:OH-+CO2=HCO3-,故答案为:OH-+CO2=HCO3-.
点评:本题考查无机物推断,注意根据乙是制氯乙烯的基础原料进行推断,需要学生熟练掌握元素化合物知识,浓度不大.

练习册系列答案
相关题目
下列物质中,所含分子数最多的是(NA表示阿伏加德罗常数)( )
| A、10 g H2 |
| B、2 mol Cl2 |
| C、1.5 NA CO2 |
| D、22.4 L O2(标准状况) |
某同学欲配制下列含有四种不同阴、阳离子的溶液,其中能配制成功的是( )
| A、Ca2+、H+、Cl-、HCO3- |
| B、Mg2+、Al3+、Cl-、SO42- |
| C、Na+、H+、NO3-、OH- |
| D、NH4+、Ag+、HCO3-、OH- |