题目内容
Ⅰ.已知可溶性硫化物在溶液中能与硫单质反应生成可溶性的多硫化物(如Na2Sn).请回答下列问题:
(1)多硫化物溶于水的电离方程式为 ;若n=3,
写出该多硫化物的电子式 .
(2)在浓Na2S溶液中滴入少量氯水,经振荡,未发现生成沉淀物,其原因是(只要求写出反应的离子方程式,下同) ; .
(3)在足量氯水中,滴入少量Na2S溶液,经振荡,也未发现生成沉淀物,若再加用盐酸酸化的BaCl2溶液,即可产生白色沉淀,其原因是 .
Ⅱ.在碘化钾和硫酸的混合溶液中加入过氧化氢水溶液,迅速发生反应,放出大量气体,反应过程可表示如下:①H2O2+2KI+H2SO4=I2+K2SO4+2H2O
②H2O2+I2=2HIO
③H2O2+2HIO=I2+O2↑+2H2O
(4)H2O2在反应③中的作用是 (填正确选项的标号).
A.氧化剂 B.还原剂C.既是氧化剂又是还原剂 D.不是氧化剂也不是还原剂
(5)有人认为上述反应说明了碘单质是过氧化氢分解的催化剂,你认为 (选填“对”或“不对”),其理由 .
(6)上述反应说明H2O2、I2、HIO氧化性从强到弱的顺序是 .
(1)多硫化物溶于水的电离方程式为
写出该多硫化物的电子式
(2)在浓Na2S溶液中滴入少量氯水,经振荡,未发现生成沉淀物,其原因是(只要求写出反应的离子方程式,下同)
(3)在足量氯水中,滴入少量Na2S溶液,经振荡,也未发现生成沉淀物,若再加用盐酸酸化的BaCl2溶液,即可产生白色沉淀,其原因是
Ⅱ.在碘化钾和硫酸的混合溶液中加入过氧化氢水溶液,迅速发生反应,放出大量气体,反应过程可表示如下:①H2O2+2KI+H2SO4=I2+K2SO4+2H2O
②H2O2+I2=2HIO
③H2O2+2HIO=I2+O2↑+2H2O
(4)H2O2在反应③中的作用是
A.氧化剂 B.还原剂C.既是氧化剂又是还原剂 D.不是氧化剂也不是还原剂
(5)有人认为上述反应说明了碘单质是过氧化氢分解的催化剂,你认为
(6)上述反应说明H2O2、I2、HIO氧化性从强到弱的顺序是
考点:氧化还原反应,氧化性、还原性强弱的比较
专题:
分析:I.(1)可溶性硫化物在溶液中完全电离出钠离子和Sn2-;Na2S3为离子化合物,S原子间存在一对共用电子对;
(2)Na2S与氯气反应生成S沉淀,S与S2-结合生成多硫离子;
(3)在足量氯水中,氯气与硫离子反应生成硫酸根离子,加盐酸酸化的BaCl2溶液生成硫酸钡沉淀;
II.(4)根据H2O2中O元素的化合价的变化分析;
(5)根据碘单质在②H2O2+I2=2HIO ③H2O2+2HIO=I2+O2↑+2H2O两个方程中的作用分析;
(6)氧化还原反应中氧化剂的氧化性大于还原剂的氧化性.
(2)Na2S与氯气反应生成S沉淀,S与S2-结合生成多硫离子;
(3)在足量氯水中,氯气与硫离子反应生成硫酸根离子,加盐酸酸化的BaCl2溶液生成硫酸钡沉淀;
II.(4)根据H2O2中O元素的化合价的变化分析;
(5)根据碘单质在②H2O2+I2=2HIO ③H2O2+2HIO=I2+O2↑+2H2O两个方程中的作用分析;
(6)氧化还原反应中氧化剂的氧化性大于还原剂的氧化性.
解答:
解:I.(1)可溶性硫化物在溶液中完全电离出钠离子和Sn2-,则多硫化物溶于水的电离方程式为Na2Sn=2Na++Sn2-;Na2S3为离子化合物,S原子间存在一对共用电子对,其电子式为: ;
;
故答案为:Na2Sn=2Na++Sn2-; ;
;
(2)在浓Na2S溶液中滴入少量氯水,Na2S与氯气反应生成S沉淀,S与S2-结合生成多硫离子,所以没有沉淀生成,其溶液中发生的反应为:S2-+Cl2=2Cl-+S↓,(n-1)S+S2-=Sn2-;
故答案为:S2-+Cl2=2Cl-+S↓;(n-1)S+S2-=Sn2-;
(3)在足量氯水中,滴入少量Na2S溶液,氯气与硫离子反应生成硫酸根离子,即S2-+4Cl2+4H2O=8Cl-+SO42-+8H+,所以没有沉淀生成,再加盐酸酸化的BaCl2溶液生成硫酸钡沉淀;
故答案为:S2-+4Cl2+4H2O=8Cl-+SO42-+8H+;
II.(4)H2O2+2HIO=I2+O2↑+2H2O中H2O2中O元素的化合价升高,被氧化,所以H2O2作还原剂,
故答案为:B;
(5)已知②H2O2+I2=2HIO ③H2O2+2HIO=I2+O2↑+2H2O两个方程相加得:2H2O2=O2↑+2H2O,反应前后碘的质量和性质没有发生变化,且过氧化氢分解放出氧气的速率加快,所以碘作催化剂;
故答案为:对;碘在反应中没有消耗(质量和化学性质均不变),且过氧化氢分解放出氧气的速率加快;
(6)①H2O2+2KI+H2SO4=I2+K2SO4+2H2O反应中H2O2为氧化剂,KI为还原剂,则氧化性:H2O2>KI,
②H2O2+I2=2HIO 反应中H2O2为氧化剂,I2为还原剂,则氧化性:H2O2>I2;
③H2O2+2HIO=I2+O2↑+2H2O反应中HIO为氧化剂,H2O2为还原剂,则氧化性:HIO>H2O2;
所以H2O2、I2、HIO氧化性从强到弱的顺序是HIO>H2O2>I2;
故答案为:HIO>H2O2>I2.
 ;
;故答案为:Na2Sn=2Na++Sn2-;
 ;
;(2)在浓Na2S溶液中滴入少量氯水,Na2S与氯气反应生成S沉淀,S与S2-结合生成多硫离子,所以没有沉淀生成,其溶液中发生的反应为:S2-+Cl2=2Cl-+S↓,(n-1)S+S2-=Sn2-;
故答案为:S2-+Cl2=2Cl-+S↓;(n-1)S+S2-=Sn2-;
(3)在足量氯水中,滴入少量Na2S溶液,氯气与硫离子反应生成硫酸根离子,即S2-+4Cl2+4H2O=8Cl-+SO42-+8H+,所以没有沉淀生成,再加盐酸酸化的BaCl2溶液生成硫酸钡沉淀;
故答案为:S2-+4Cl2+4H2O=8Cl-+SO42-+8H+;
II.(4)H2O2+2HIO=I2+O2↑+2H2O中H2O2中O元素的化合价升高,被氧化,所以H2O2作还原剂,
故答案为:B;
(5)已知②H2O2+I2=2HIO ③H2O2+2HIO=I2+O2↑+2H2O两个方程相加得:2H2O2=O2↑+2H2O,反应前后碘的质量和性质没有发生变化,且过氧化氢分解放出氧气的速率加快,所以碘作催化剂;
故答案为:对;碘在反应中没有消耗(质量和化学性质均不变),且过氧化氢分解放出氧气的速率加快;
(6)①H2O2+2KI+H2SO4=I2+K2SO4+2H2O反应中H2O2为氧化剂,KI为还原剂,则氧化性:H2O2>KI,
②H2O2+I2=2HIO 反应中H2O2为氧化剂,I2为还原剂,则氧化性:H2O2>I2;
③H2O2+2HIO=I2+O2↑+2H2O反应中HIO为氧化剂,H2O2为还原剂,则氧化性:HIO>H2O2;
所以H2O2、I2、HIO氧化性从强到弱的顺序是HIO>H2O2>I2;
故答案为:HIO>H2O2>I2.
点评:本题考查了氧化还原反应、电解质的电离、电子式、离子方程式的书写等,题目涉及的知识点较多,侧重于考查学生对基础知识的应用能力,把握氧化还原反应的规律应用是解题关键,题目难度中等.

练习册系列答案
相关题目
下列电离方程式错误的是( )
| A、Na2CO3=2Na++CO32- |
| B、NaHSO4=Na++H++SO42- |
| C、NaHCO3=Na++HCO3- |
| D、KClO3=K++Cl-+3O2- |
四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法不正确的是( )
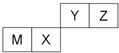

| A、Z位于元素周期表中第2周期、第ⅥA族 |
| B、原子半径Z<M |
| C、Y的最高价氧化物对应水化物的酸性比X的弱 |
| D、X的最简单气态氢化物的热稳定性比Z的小 |
下列关于乙烯和聚乙烯的叙述中正确的是( )
| A、二者都能使溴水褪色 |
| B、二者互为同系物 |
| C、二者实验式相同 |
| D、二者相对分子质量相同 |
 为测定放置一段时间的小苏打样品中纯碱的质量分数,某化学兴趣小组设计如下实验方案:
为测定放置一段时间的小苏打样品中纯碱的质量分数,某化学兴趣小组设计如下实验方案: