题目内容
4.化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳.而氢气和氨气都被认为是无碳无污染的清洁能源.(一)“氢能”将是未来最理想的新能源.
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M+xH2=MH2x△H<0 (M表示某种合金)
图1表示温度分别为T1,T2时,最大吸氢量与氢气压强的关系.则下列说法中,正确的是cd
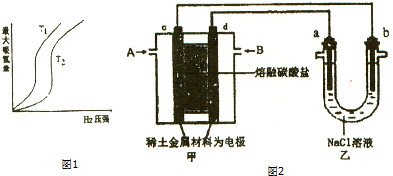
a、T1>T2
b、增大M的量,上述平衡向右移动
c、增大氢气压强,加快氢气的吸收速率
d、上述反应可实现多次储存和释放氢气
(2)在25℃,101KPa条件下,1g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol.
(3)工业上通常用生产水煤气的方法制得氢气.其中C(s)+H2O(g)≒CO(g)+H2(g),在850℃时平衡常数K=1.若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O.
①当加热到850℃反应达到平衡的标志有AC.
A.容器内的压强不变 B.消耗水蒸气的物质的量与生成CO的物质的量相等
C.混合气的密度不变 D.单位时间有n个H-O键断裂的同时有n个H-H键断裂
②x应满足的条件是x>2.
(二)CO2是合成尿素的原料.现在以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如图2装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体.乙装置中a、b为石墨,电解一段时间后,b电极附近滴入酚酞溶液变红,NaCl溶液的体积为100mL.
(1)工作过程中,甲装置中d电极的电极反应式是O2+4e-+CO2=CO32-,乙装置中 电极b为阴极(填电极名称).
(2)若在a极产生112mL(标准状况)气体,25℃时乙装置中所得溶 液pH=13.(忽略电解前后溶液体积变化)
(三) 氨是制备尿素的原料,NH3、N2H4等在工农业生产、航空 航天等领域有广泛应用.
氨气溶于水得到氨水,在25℃下,将a mol/L的氨水与b mol/L的硫酸以3:2体积比混合反应后溶液呈中性.用含a和b的代数式表示出氨水的电离平衡常数为$\frac{4b}{3a-4b}×1{0}^{-7}$.
分析 (一)(1)在压强相同的条件下,T1对应的吸氢量大,也就是T2→T1,平衡正向移动,而正反应是放热反应,平衡常数是温度的函数,温度不变平衡常数不变,结合表达式分析求解;
(2)1g氢气完全燃烧生成液态水时放出142.9kJ热量,2g氢气燃烧生成液态水放热285.8KJ,燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,结合热化学方程式书写;
(3)①化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;
②设转化的水为amol,根据平衡常数进行计算.
(二)以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如图2装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体,
图2乙装置中a、b为石墨电极,电解一段时间后,b电极附近滴入酚酞溶液变红,说明溶液中氢离子得到电子发生还原反应,则b电极为电解池阴极,a为电解池阳极,和b电极相连的电极c电极为负极,与a电极相连的d电极为原电池正极,A端通入氢气,B端通入O2和CO2的混合气体,
①甲装置中d电极为阳极,电极上的电极反应式是氧气得到电子在熔融盐中和二氧化碳反应生成碳酸根离子;
②依据电极反应和电子守恒计算,a极为电解池阳极,产生112mL(标准状况)气体为氢气物质的量=$\frac{0.112L}{22.4L/mol}$=0.005mol,电极反应为:2H++2e-=H2↑,电子转移0.01mol,消耗氢离子物质的量0.01mol,溶液中生成氢氧根离子物质的量为0.01mol,计算氢氧根离子浓度得到溶液pH;
(三)根据电荷守恒:c(H+)+c(NH4+)=c(OH-)+2c(SO42-),现已知c(H+)=c(OH-),所以c(NH4+)=2c(SO42-);Kb(NH3•H2O)=$\frac{c(O{H}^{-})•c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$,c(OH-)=10-7mol•L-1,c(NH4+)=$\frac{4b}{5}$mol•L-1,c(NH3•H2O)=($\frac{3a}{5}$-$\frac{4b}{5}$)mol•L-1,据此分析.
解答 解:(1)在压强相同的条件下,T1对应的吸氢量大,也就是T2→T1,平衡正向移动,而正反应是放热反应,所以T2→T1,是降温,所以T2>T1,
a.T1<T2,故a错误;
b.M为固体,增大M的量,浓度不变,上述平衡不移动,故b错误;
c.增大氢气压强,反应速率加快,氢气的吸收速率加快,故c正确;
d.金属储氢的原理可表示为:M(s)+xH2═MH2x(s)△H<0 平衡可以正向或逆向进行,反应可实现多次储存和释放氢气,故d正确;
故答案为:cd;
(2)1g氢气完全燃烧生成液态水时放出142.9kJ热量,2g氢气燃烧生成液态水放热285.8KJ,则氢气燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;
(3)①C(s)+H2O(g)?CO(g)+H2(g),
A.反应前后气体的体积不等,故容器内的压强不变可作为判断是否达到化学平衡状态的依据,故A正确;
B.消耗水蒸气是正反应,生成CO也是正反应,故消耗水蒸气的物质的量与生成CO的物质的量相等不能作为判断是否达到平衡状态的依据,故B错误;
C.密度=$\frac{总质量}{体积}$,总质量在变,体积不变,故混合气的密度不变可作为判断是否达到化学平衡状态的依据,故C正确;
D.单位时间有n个H-O键断裂是正反应,同时有n个H-H键断裂是逆反应,但正逆反应速率不等,故单位时间有n个H-O键断裂的同时有n个H-H键断裂不能作为判断是否达到平衡状态的依据,故D错误,
故答案为:AC;
②C(s)+H2O(g)?CO(g)+H2(g),
开始(mol):6 0 0
转化(mol):a a a
平衡(mol):6-a a a
K=$\frac{a×a}{6-a}$=1,a=2,故x应满足的条件是:x>2,
故答案为:x>2;
(二)以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如图2装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体,
图2乙装置中a、b为石墨电极,电解一段时间后,b电极附近滴入酚酞溶液变红,说明溶液中氢离子得到电子发生还原反应,则b电极为电解池阴极,a为电解池阳极,和b电极相连的电极c电极为负极,与a电极相连的d电极为原电池负极,A端通入氢气,B端通入O2和CO2的混合气体,
①甲装置中d电极为正极,电极上的电极反应式是氧气得到电子在熔融盐中和二氧化碳反应生成碳酸根离子,电极反应为:O2+4e-+CO2=CO32-,b为阴极.
故答案为:O2+4e-+CO2=CO32-,阴;
②依据电极反应和电子守恒计算,a极为电解池阳极,产生112mL(标准状况)气体为氢气物质的量=$\frac{0.112L}{22.4L/mol}$=0.005mol,电极反应2H++2e-=H2↑,消耗氢离子物质的量为0.01mol,溶液中生成氢氧根离子物质的量为0.01mol,溶液中氢氧根离子浓度c(OH-)=$\frac{0.01mol}{0.1L}$=0.1mol/L,溶液中c(H+)=$\frac{1{0}^{-14}}{0.1}$=10-13mol/L,溶液PH=13,
故答案为:13;
(三)根据电荷守恒:c(H+)+c(NH4+)=c(OH-)+2c(SO42-),现已知c(H+)=c(OH-),所以c(NH4+)=2c(SO42-);Kb(NH3•H2O)=$\frac{c(O{H}^{-})•c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$,c(OH-)=10-7mol•L-1,c(NH4+)=$\frac{4b}{5}$mol•L-1,c(NH3•H2O)=($\frac{3a}{5}$-$\frac{4b}{5}$)mol•L-1,;Kb(NH3•H2O)=$\frac{c(O{H}^{-})•c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{(\frac{4b}{5})×1{0}^{-7}}{(\frac{3}{5}a-\frac{4}{5}b)}$=$\frac{4b}{3a-4b}×1{0}^{-7}$,故答案为:$\frac{4b}{3a-4b}×1{0}^{-7}$.
点评 本题考查了图象的理解应用,主要是化学反应速率、化学平衡影响因素、平衡标志、原电池和电解池原理的分析应用,掌握基础是解题关键,题目难度中等.

| A. | Cl2 | B. | SO2 | C. | CuSO4 | D. | O2 |
| A. | 氮肥NH4NO3在重力撞击下可能发生爆炸 | |
| B. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| C. | 单质硅可用于制备太阳能电池板,二氧化硅可用于制作光导纤维 | |
| D. | 聚酯纤维、碳纤维、光导纤维都属于有机高分子材料 |
| A. | 已知C-C键可以绕键轴自由旋转,结构简式为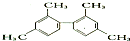 的分子中至少有11个碳原子处于同一平面上 的分子中至少有11个碳原子处于同一平面上 | |
| B. | 苯中含有杂质苯酚,可用浓溴水来除杂 | |
| C. | 1mo1 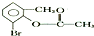 在一定条件下与足量NaOH溶液反应,最多消耗3 mol NaOH 在一定条件下与足量NaOH溶液反应,最多消耗3 mol NaOH | |
| D. | 按系统命名法,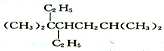 的名称为3,3,6一三甲基-4-乙基庚烷 的名称为3,3,6一三甲基-4-乙基庚烷 |
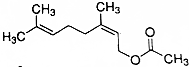 某酯是一种食用香料,其结构简式如图所示,有关该酯叙述正确的是( )
某酯是一种食用香料,其结构简式如图所示,有关该酯叙述正确的是( )| A. | 分子式为C12H18O2 | |
| B. | 能发生加成反应、取代反应和消去反应 | |
| C. | 能使酸性KMn04溶液和溴水褪色,且褪色原理相同 | |
| D. | 1mol该有机物在一定条件下和H2反应,共消耗H2为2mol |
 又名萘,则萘的化学式为( )
又名萘,则萘的化学式为( )| A. | C10H10 | B. | C10H8 | C. | C12H10 | D. | C10H12 |
| A. | 石油的分馏和煤的干馏都属于物理变化 | |
| B. | 通过对95%的酒精直接蒸馏获得无水酒精 | |
| C. | 在石油的分馏、实验室制乙烯以及制备硝基苯的三个实验中,温度计水银球的位置分别位于蒸馏烧瓶支管口、反应液液面以下、水浴中 | |
| D. | 用C8H18萃取溴水中的溴,可观察到溶液分层,下层为橙红色,上层接近无色 |
 在一个U形管里盛有氯化铜溶液,并插入Zn片和C棒作电极,按下图连接.
在一个U形管里盛有氯化铜溶液,并插入Zn片和C棒作电极,按下图连接.